题目内容
9. Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用.(l) C、N、O三种元素的第一电离能有大到小的顺序为N>O>C.
(2)与N3-含有相同电子数的三原子分子的空间构型是V形.
(3)Cu+的电子排布式为1s22s22p63s23p63d10,其在酸性溶液中不稳定,可发生歧化反
应生成Cu2+和Cu.但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成 Cu2OCu+的3d轨道上电子全满其结构稳定.
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是sp3、sp2乙醛分子中H-C一O的键角大于 (填“大于”“等于”或“小于”)乙醛分子中的H-C-O的键角.
(5)[cu(H2O)]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式
 .
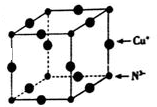
.(6)Cu3N的晶胞结构如图所示,N3-的配位数为6Cu+的半径为a pm,N3-的半径为b pm,Cu3N的密度为$\frac{103×1{0}^{30}}{4(a+b){\;}^{3}N{\;}_{A}}$g•cm -3(阿伏加德罗常数用NA表示).
分析 (1)同周期自左而右元素第一电离能呈增大趋势,但N元素原子的2p能级含有3个电子,处于半满稳定状态,能量较低,失去第1个电子需要的能量较大;
(2)与N3-含有相同电子数的微粒为等电子体,如NO2-,等电子体结构相似,根据价层电子对互斥理论确定其空间构型;
(3)Cu+的核外有28个电子,根据构造原理书写其基态离子核外电子排布式,原子轨道处于全空、半满或全满时最稳定;
(4)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,据此判断碳原子的杂化方式,碳原子杂化方式不同导致其键角不同;
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子,说明该分子的结构不对称;
(6)Cu3N的晶胞结构如图,大球个数=12×$\frac{1}{4}$=3,小球个数=$\frac{1}{8}×8$=1,所以大球表示Cu原子、小球表示N原子,N3-的配位数=3×2=6,Cu3N的密度=$\frac{m}{V}$.
解答 解:(1)同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去第一个电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
故答案为:N>O>C;
(2)与N3-含有相同电子数的微粒为等电子体,如NO2-,得电子体结构相似,亚硝酸根离子中N原子价层电子对个数=2+$\frac{1}{2}$×(5+1-2×2)=3且含有一个孤电子对,所以为V形结构,
故答案为:V形;
(3)Cu+的核外有28个电子,根据构造原理知其基态离子核外电子排布式1s22s22p63s23p63d10,原子轨道处于全空、半满或全满时最稳定,Cu+的3d轨道上全满,稳定,
故答案为:1s22s22p63s23p63d10;Cu+的3d轨道上电子全满其结构稳定;
(4)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,所以甲基中的碳原子采用sp3杂化,醛基中的碳原子采用sp2杂化,醛基中碳原子采用sp2杂化、乙醇中含有醇羟基的碳原子采用sp3杂化,导致乙醛分子中H-C-O的键角大于乙醇分子中的H-C-O的键角,
故答案为:sp3、sp2;大于;
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子,说明该分子的结构不对称,则其结构式为 ,
,
故答案为: ;
;
(6)Cu3N的晶胞结构如图,大球个数=12×$\frac{1}{4}$=3,小球个数=$\frac{1}{8}×8$=1,所以大球表示Cu原子、小球表示N原子,N3-的配位数=3×2=6,晶胞的体积=[(2a+2b)×10-10cm]3,Cu3N的密度=$\frac{m}{V}$=$\frac{\frac{64×3+14}{{N}_{A}}}{[(2a+2b)×10{\;}^{-10}]{\;}^{3}}$g/cm3=$\frac{103×1{0}^{30}}{4(a+b){\;}^{3}N{\;}_{A}}$g/cm3,
故答案为:6;$\frac{103×1{0}^{30}}{4(a+b){\;}^{3}N{\;}_{A}}$.
点评 本题考查了物质结构和性质,涉及晶胞的计算、原子杂化、核外电子排布等知识点,根据密度公式、价层电子对互斥理论、构造原理等知识点来分析解答,这些知识点都是考试热点,难点是晶胞的计算,明确各个字母的含义,注意(1)中采用知识迁移的方法进行解答,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 氨水使湿润的红色石蕊试纸变蓝:NH3•H2O?NH4++OH- | |
| B. | 工业上用过量的NaOH溶液吸收:SO2:SO2+OH-=HSO3- | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 用石灰乳吸收泄露的氯气:Ca(OH)2+Cl2=Ca2++Cl-+ClO-+H2O |
| A. | CO2的电子式: | |
| B. | Cl原子的结构示意图: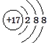 | |
| C. | 质子数为53,中子数为78的碘原子的核素符号:${\;}_{53}^{131}$I | |
| D. | 2,3-二甲基-2-丁烯的结构简式: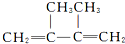 |
| A. | 三聚氰胺(分子式:C3H6N6)含氮量很高,可作为牛奶添加剂 | |
| B. | 聚氯乙烯能使溴的四氯化碳溶液褪色 | |
| C. | 为了减少“白色污染”,我国规定商家不得提供塑料袋 | |
| D. | 低碳生活就是节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
| A. | 步骤①的化学方程式为:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | 步骤①②③中每生成或反应1mol Si,转移4mol电子 | |
| C. | 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应 | |
| D. | SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3 |
| A. | 用饱和硫酸铵溶液沉淀蛋白质 | |
| B. | 用生石灰干燥氨气 | |
| C. | 用铝制的容器盛装浓硫酸 | |
| D. | 用饱和碳酸钠溶液收集实验室制取的乙酸乙酯 |

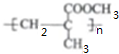 .
.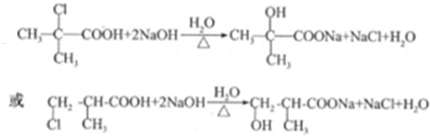 (任写一个)
(任写一个)