题目内容
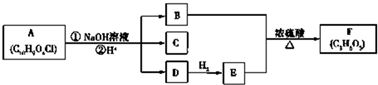
1.纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业.在浓CaCl2溶液中通人NH3和CO2,可以制得纳米级碳酸钙.某校学生实验小组设计下图所示装置制取该产品,D中装有稀硫酸的脱脂棉(图中夹持装置已略去).I.可选用的药品有a.石灰石b.饱和氯化钙溶液c.6mol/L盐酸d.氯化铵固体e.氢氧化钙固体.
(1)A中制备气体时,所需药品是(选填字母序号)ac;
(2)B中盛有饱和碳酸氢钠溶液,其作用是除去CO2中的HCl;
(3)写出制取氨气的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入的气体是NH3(写化学式)
(5)检验D出口处是否有氨气逸出的方法是将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出;
(6)写出制取纳米级碳酸钙的化学方程式CaCl2+CO2+H2O+2NH3=2NH4Cl+CaCO3↓.

分析 (1)实验室制备二氧化碳用盐酸与碳酸钙反应;
(2)二氧化碳在饱和碳酸氢钠溶液中溶解度不大,氯化氢能够与碳酸氢钠反应生成二氧化碳;
(3)氯化铵与氢氧化钙反应生成氯化钙、氨气和水;
(4)根据二氧化碳和氨气的溶解性判断先通入的气体;
(5)氨气为碱性气体,与水反应生成一水合氨,能够使湿润红色湿润试纸变蓝;
(6)根据二氧化碳和氨气的溶解性判断先通入的气体,由反应物和生成物写出反应方程式.
解答 解:(1)装置A为制备二氧化碳装置,根据二氧化碳的实验室制法,可知装置中盛放的是碳酸钙和稀盐酸,即选择a、c,故答案为:ac;
(2)二氧化碳在饱和碳酸氢钠溶液中溶解度不大,氯化氢能够与碳酸氢钠反应生成二氧化碳,B中盛有饱和碳酸氢钠溶液,起到除去二氧化碳中的氯化氢的作用;
故答案为:饱和碳酸氢钠;除去CO2中的HCl;
(3)氯化铵与氢氧化钙反应生成氯化钙、氨气和水,化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(4)氨气极易溶于水,易于二氧化碳的吸收,所以应先通入氨气,故答案为:NH3;
(5)氨气能使湿润的红色石蕊试纸变蓝,所以检验氨气的方法:将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出;
故答案为:将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出;
(6)氨气极易溶于水,二氧化碳不易溶于水,所以应先通入氨气;氨气溶于水生成氨水,溶液呈碱性,二氧化碳是酸性气体,能和碱反应生成碳酸铵,碳酸铵和氯化钙发生复分解反应生成碳酸钙和氯化铵CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl.
故答案为CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl.
点评 本题考查了氨气的实验室制法和性质的检验,明确氯气的性质是解题关键,注意反应装置、除杂装置的选择,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| B. | 10mol•L-1的浓氨水:Al3+、NH4+、NO3-、I- | |
| C. | 0.1mol•L-1KMnO4溶液:Na+、Fe2+、SO42-、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液K+、Na+、AlO2-、CO32- |
| A. | 气态氢化物的稳定性:HCl>HBr>HI | B. | 离子半径:S2->Na+>O2- | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 熔点:SiO2>NaCl>干冰 |
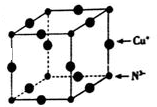 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用. .
.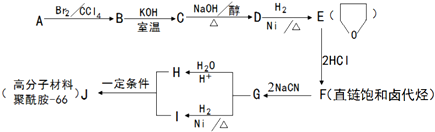
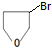 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$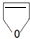 +NaBr+H2O.
+NaBr+H2O.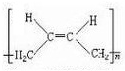 .
.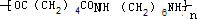 +2nH2O.
+2nH2O. .
.
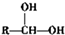 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$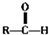 (R为羟基)
(R为羟基) .
. .
.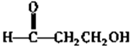 .
.
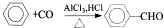
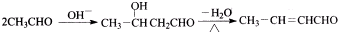
 .
.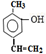 .
.