题目内容
20.解释下列事实的离子方程式不正确的是( )| A. | 氨水使湿润的红色石蕊试纸变蓝:NH3•H2O?NH4++OH- | |
| B. | 工业上用过量的NaOH溶液吸收:SO2:SO2+OH-=HSO3- | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 用石灰乳吸收泄露的氯气:Ca(OH)2+Cl2=Ca2++Cl-+ClO-+H2O |
分析 A.一水合氨为弱电解质,部分电离;
B.二氧化硫少量反应生成亚硫酸钠;
C.氢氧化钠与氧化铝反应生成偏铝酸钠和水;
D.氯离子书写错误.
解答 解:A.氨水使湿润的红色石蕊试纸变蓝,一水合氨电离方程式:NH3•H2O?NH4++OH-,故A正确;
B.工业上用过量的NaOH溶液吸收:SO2:SO2+2OH-=H2O+SO32-,故B错误;
C.氧化铝为两性氧化物,能够与氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为2OH-+Al2O3═2AlO2-+H2O,故C正确;
D.用石灰乳吸收泄露的氯气:Ca(OH)2+Cl2=Ca2++Cl-+ClO-+H2O,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.某化学兴趣小组设计如图所示装置来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物.下列说法不正确的是( )
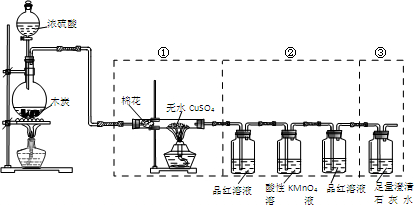

| A. | 实验时可观察到装置①中白色硫酸铜粉末变蓝色 | |
| B. | 装置②中前后两次观察到品红溶液的现象应不相同 | |
| C. | 装置③用于检验产物中二氧化碳气体的生成 | |
| D. | 如果将仪器的连接顺序变为②③①,同样可以检出所有气体产物 |
15.同类晶体物质熔、沸点的变化是有规律的,试分析下列两组物质熔点规律性变化的原因:
晶体熔、沸点的高低,决定于组成晶体微粒间的作用力的大小.A组是离子晶体,晶体微粒之间通过离子相连.B组晶体属金属键结合而成的金属晶体,价电子数由少到多的顺序是Na<Mg<Al,粒子半径由大到小的顺序是Na+>Mg2+>Al3+.
| 物质 | A | NaCl | KCl | CaCl2 |
| 熔点(K) | 1074 | 918 | ||
| 物质 | B | Na | Mg | Al |
| 熔点(K) | 317 | 923 | 933 |
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| B. | 10mol•L-1的浓氨水:Al3+、NH4+、NO3-、I- | |
| C. | 0.1mol•L-1KMnO4溶液:Na+、Fe2+、SO42-、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液K+、Na+、AlO2-、CO32- |
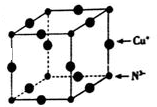 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用. .
.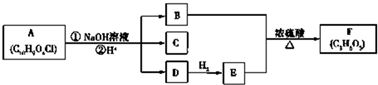
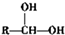 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$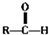 (R为羟基)
(R为羟基) .
. .
.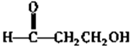 .
.