题目内容
14.高纯度晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.它可以按下列方法制备:SiO2 $→_{高温}^{①C}$Si(粗)$→_{300℃}^{②HCl}$SiHCl3$→_{1000℃--1100℃}^{③过量H_{2}}$Si(纯),下列说法正确的是( )| A. | 步骤①的化学方程式为:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | 步骤①②③中每生成或反应1mol Si,转移4mol电子 | |
| C. | 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应 | |
| D. | SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3 |
分析 A、二氧化硅高温下与C反应生成CO气体;
B、氧化还原反应得失电子守恒判断即可;
C、硅能与氢氟酸反应生成SiF4和氢气;
D、由沸点可知,为相差30℃以上的两种液体.
解答 解:A、二氧化硅高温下与C反应生成CO气体,即步骤①的化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故A错误;
B、步骤①中Si的化合价降低4,转移电子数为4mol,步骤②中生成SiHCl3,化合价升高2,步骤③中每生成1mol Si,转移2mol电子,故B错误;
C、硅能与氢氟酸反应生成SiF4和氢气,故C错误;
D、沸点相差30℃以上的两种液体可以采用蒸馏的方法分离,故D正确,
故选D.
点评 本题是一道有关硅的无机推断题,考查的知识点范围较广,涉及氧化还原反应原理应用、蒸馏等,可以根据已有知识进行.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
19.为了避免NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:2NO2+2NaOH=NaNO2+H2O;NO2+NO+2NaOH=2NaNO2+H2O).现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度为( )
| A. | $\frac{a+b+c}{V}$molgL-1 | B. | $\frac{a+b+2c}{V}$molgL-1 | C. | $\frac{2a+b+c}{V}$molgL-1 | D. | $\frac{b+2c}{V}$molgL-1 |
4.设NA为阿伏加德罗常数的数值,下列说法中,正确的是( )
| A. | 22.4 L Cl2完全溶于氢氧化钠溶液时,转移电子数为NA | |
| B. | 常温下,1 L pH=1的H2SO4溶液中含有的H+的数目为0.2NA | |
| C. | 标准状况下,2.24 L NH3中含有共价键的数目为0.3NA | |
| D. | 常温下,22.4 L NO2和N2O4的混合气体中含有NA个氧原子 |
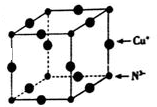 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用. .
.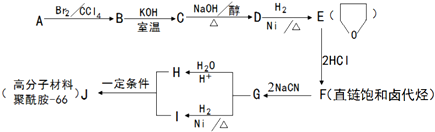
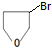 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$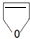 +NaBr+H2O.
+NaBr+H2O.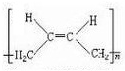 .
.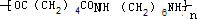 +2nH2O.
+2nH2O. X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满.
X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满.