题目内容
17.下列说法正确的是( )| A. | CO2的电子式: | |
| B. | Cl原子的结构示意图: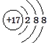 | |
| C. | 质子数为53,中子数为78的碘原子的核素符号:${\;}_{53}^{131}$I | |
| D. | 2,3-二甲基-2-丁烯的结构简式: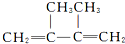 |
分析 A.二氧化碳为共价化合物,分子中存在两个碳氧双键;
B.氯离子的核电荷数=核外电子总数=17,最外层为7个电子;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.二烯烃的命名中需要标出两个碳碳双键的位置.
解答 解:A.二氧化碳分子中存在两个碳氧双键,其正确的电子式为: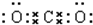 ,故A错误;
,故A错误;
B.氯离子的核电荷数、核外电子总数都是17,其原子结构示意图为: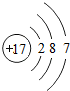 ,故B正确;
,故B正确;
C.质子数为53,中子数为78的碘原子的质量数为131,该核素符号为:${\;}_{53}^{131}$I,故C正确;
D.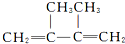 为二烯烃,碳碳双键位于1、3号C,甲基在2、3号C,该有机物名称为:2,3-二甲基-1,3-二烯烃,故D错误;
为二烯烃,碳碳双键位于1、3号C,甲基在2、3号C,该有机物名称为:2,3-二甲基-1,3-二烯烃,故D错误;
故选
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,注意掌握原子结构示意图与离子结构示意图、电子式、元素符号等化学用语的书写原则,明确有机物命名的原则,试题培养了学生规范答题的能力.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
8.某化学兴趣小组设计如图所示装置来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物.下列说法不正确的是( )
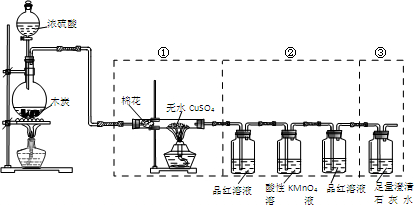

| A. | 实验时可观察到装置①中白色硫酸铜粉末变蓝色 | |
| B. | 装置②中前后两次观察到品红溶液的现象应不相同 | |
| C. | 装置③用于检验产物中二氧化碳气体的生成 | |
| D. | 如果将仪器的连接顺序变为②③①,同样可以检出所有气体产物 |
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| B. | 10mol•L-1的浓氨水:Al3+、NH4+、NO3-、I- | |
| C. | 0.1mol•L-1KMnO4溶液:Na+、Fe2+、SO42-、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液K+、Na+、AlO2-、CO32- |
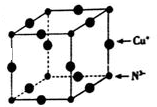 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用. .
.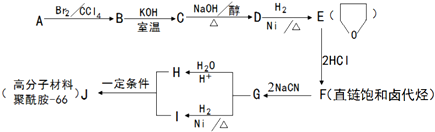
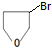 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$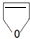 +NaBr+H2O.
+NaBr+H2O.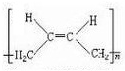 .
.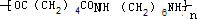 +2nH2O.
+2nH2O.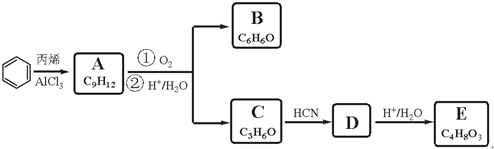
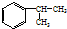 ,A的含有苯环的同分异构体(除A外)有7种.
,A的含有苯环的同分异构体(除A外)有7种.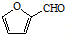 )是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式
)是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式 .
. G:
G: .
.