题目内容
【题目】已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003molL﹣1s﹣1 . ,则6s时c(A)= molL﹣1 , C的物质的量为mol;若反应经一段时间后,达到平衡时A的转化率为 , 如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为;
(3)判断该反应是否达到平衡的依据为(填正确选项前的字母): a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为 .
【答案】
(1)![]() ;<
;<
(2)0.022;0.09;80%;80%
(3)c
(4)2.5
【解析】解:(1)可逆反应A(g)+B(g)C(g)+D(g)的平衡常数表达式k= ![]() ,
,
由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0,
所以答案是: ![]() ;<;(2)反应初始6s内A的平均反应速率v(A)=0.003molL﹣1s﹣1,则6s内△c(A)=0.003molL﹣1s﹣1×6s=0.018mol/L,A的起始浓度为
;<;(2)反应初始6s内A的平均反应速率v(A)=0.003molL﹣1s﹣1,则6s内△c(A)=0.003molL﹣1s﹣1×6s=0.018mol/L,A的起始浓度为 ![]() =0.04mol/L,故6s时时c(A)=0.04mol/L﹣0.018mol/L=0.022mol/L,
=0.04mol/L,故6s时时c(A)=0.04mol/L﹣0.018mol/L=0.022mol/L,
故6s内△n(A)=0.018mol/L×5L=0.09mol,由方程式可知n(C)=△n(A)=0.09mol,
设平衡时A的浓度变化量为x,则:
A(g)+ | B(g) | C(g)+ | D(g) | |
起始(mol/L) | 0.04 | 0.16 | 0 | 0 |
转化(mol/L) | x | x | x | x |
平衡(mol/L) | 0.04-x | 0.16-x | x | x |
故 ![]() =1,解得x=0.032
=1,解得x=0.032
所以平衡时A的转化率为 ![]() ×100%=80%,
×100%=80%,
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变为80%,
所以答案是:0.022;0.09;80%;80%;(3)a.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,故a错误,
b.混合气体的总质量不变,容器的容积不变,故混合气体的密度始终不变,故气体的密度不随时间改变,不能说明到达平衡,故b错误,
c.可逆反应到达平衡时,各组分的浓度不发生变化,故c(A)不随时间改变,说明到达平衡,故c正确,
d.单位时间里生成C和D的物质的量相等,都表示正反应速率,反应始终按1:1生成C、D的物质的量,不能说明到达平衡,故d错误,
所以答案是:c;(4)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数,故1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为 ![]() =2.5,
=2.5,
所以答案是:2.5.
【考点精析】解答此题的关键在于理解化学平衡常数的含义的相关知识,掌握指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态,以及对化学平衡状态本质及特征的理解,了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】三氯氧磷(POCl3)是一种重要的化工原料,工业上可以直接氧化PCl3制备POCl3,反应原理为:P4(白磷)+6Cl2=4PCl3 2PCl3+O2=2POCl3
PCl3、POCl3的部分性质如下:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl |
某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去) :
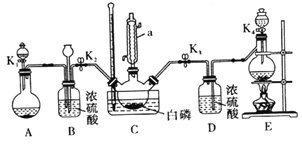
(1)仪器a 的名称为_______________,B装置中长颈漏斗的作用是___________________。
(2)装置E用来制取Cl2,反应的离子方程式为_____________________。
(3)为使实验顺利进行,还需补充的装置为____________________。
(4)反应时,需严格控制三个条件:
①先制取___________,缓慢地通入C 中,直至C 中的白磷消失后,再通入另一种气体。
②C装置用水浴加热控制温度为60 ℃~65℃,除加快反应速率外,另一目的是___________________。
③反应物必须干燥,否则会在C 装置中产生大量的白雾,其主要成分为___________(写化学式)。
(5)反应结束后通过下面步骤测定POCl3产品中Cl 的含量,元素Cl 的质量分数为_______________(写出计算式)。
Ⅰ.取xg产品于锥形瓶中,加入足量NaOH 溶液,POCl3完全反应后加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入0.1000 mol/L 的AgNO3 溶液40.00 mL,使Cl-完全沉淀;
Ⅲ.再向锥形瓶中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;
Ⅳ.然后加入指示剂,用c mol/LNH4SCN溶液滴定过量Ag+ 至终点,记下所用体积为VmL。
(己知:AgPO4溶于酸,Ksp(AgCl )=32×10-10,Ksp(AgSCN )=2×10-12)