题目内容
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如下图所示,其中W的最高正价和最低负价的代数和为2。下列判断正确的是( )
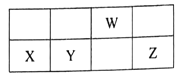
![]()
A. 最高价氧化物对应水化物的酸性:Y>W
B. 最简单气态氢化物的稳定性:Z>Y
C. 元素W与元素Y形成的化合物Y3W4是一种新型有机材料
D. X的单质能与W的最高价氧化物对应水化物的浓溶液反应产生氢气
【答案】B
【解析】短周期元素W、X、Y、Z在元素周期表中的相对位置如下图所示,其中W的最高正价和最低负价的代数和为2,则W为氮元素,故X为铝元素、Y为硅元素、Z为硫元素。A. 氮的非金属性强于硅,故最高价氧化物对应水化物的酸性:Y<W,选项A错误;B. 同周期元素从左到右非金属性逐渐增强,氢化物的稳定性增强,故最简单气态氢化物的稳定性:Z>Y,选项B正确;C. 元素W与元素Y形成的化合物Si3N4是一种无机非金属材料,选项C错误;D. X的单质铝常温下被W的最高价氧化物对应水化物的浓溶液浓硝酸钝化,不能产生氢气,选项D错误。答案选B。

 灵星计算小达人系列答案
灵星计算小达人系列答案【题目】用标准NaOH溶液滴定充满HCl的烧瓶(标况下)做完喷泉实验后得到的稀盐酸,以测定它的准确浓度,请你回答下列问题:
(1)理论计算该盐酸的物质的量浓度为:________________________________。
(2)若用甲基橙作指示剂,达到满定终点时的现象是___________________________。
(3)现有三种浓度的标准NaOH溶液,你认为最合适的是下列第__________种。
①5.00mol·L-1 ②0.500mol·L-1 ③0.0500mol·L-1
(4)若采用上述最合适浓度的标准NaOH溶液满定,滴定时实验数据列表如下:
实验次数编号 | 待测盐酸体积(mL) | 滴入NaOH溶液体积(mL) |
1 | 10.00 | 8.48 |
2 | 10.00 | 8.52 |
3 | 10.00 | 8.00 |
求这种待测稀盐酸的物质的量浓度c(HCl)=___________________。
(5)在滴定操作过程中,以下各项操作使测定值偏高的有:_______________
①滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗
②滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡
③滴定前平视,滴定终了俯视
④看到颜色变化后立即读数
⑤洗涤锥形瓶时,误把稀食盐水当做蒸馏水进行洗涤
【题目】已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003molL﹣1s﹣1 . ,则6s时c(A)= molL﹣1 , C的物质的量为mol;若反应经一段时间后,达到平衡时A的转化率为 , 如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为;
(3)判断该反应是否达到平衡的依据为(填正确选项前的字母): a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为 .