题目内容
【题目】其同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、Si02、A12O3),不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如图流程:
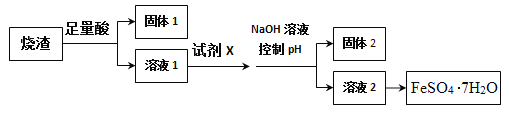
已知,某些金属阳离子可以通过“控制pH”[既调节溶液的酸碱性,pH=-lgc(H+)),pH值越大,碱性越强]使其转化为沉淀。固体2为白色沉淀。
(1)加足量酸之前,烧渣需经过进一步粉碎处理,粉碎的目的是__________。
(2)溶解烧渣选用的足量酸能否是盐酸,并说明理由_____。
(3)固体1有诸多用途,请列举其中一个____,试剂X的作用是______。
(4)某同学在控制pH这步操作时不慎将氢氧化钠溶液加过量了,结果得到的白色沉淀迅速转化为灰绿色,最终变为红褐色沉淀。请用化学用语解释固体2白色变成红褐色的原_____________。
(5)从溶液2中得到绿矾的过程中除需控制温度,防止产品分解外还应注意______。
(6)唐代苏敬《新修本草》对绿矾有如下描述:“本来绿色,新出窑未见风者,正如琉璃。陶及今人谓之石胆,烧之赤色。”另已知1mol绿矾隔绝空气高温煅烧完全分解,转移NA个电子。试写出绿矾隔绝空气高温煅烧分解的化学反应方程式____________。
【答案】 增大接触面积,加快反应速率 不能 因最终产品需要的是SO42-,用盐酸会引入Cl- 制备光导纤维或普通玻璃等 还原三价铁 4Fe(OH)2+O2+2H2O=4Fe(OH)3 隔绝空气,防止产品被氧化 2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
【解析】硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、Si02、A12O3,不考虑其它杂质),混合物中加入足量硫酸,Fe2O3、Al2O3与酸反应生成的硫酸铁、硫酸铝,二氧化硅不反应,过滤,固体1为二氧化硅;在滤液中加入铁粉将铁离子还原为亚铁离子,调节pH值使铝离子完全生成氢氧化铝沉淀,过滤,固体2为氢氧化铝,溶液2为硫酸亚铁,蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,以此进行解答。
(1)加足量酸之前,烧渣需经过进一步粉碎处理,粉碎的目的是增大反应物的接触面积,加快反应速率。
(2)由于最终产品需要的是SO42-,用盐酸会引入Cl-,所以溶解烧渣选用的足量酸不能是盐酸。
(3)根据以上分析可知固体1是二氧化硅,可用来制备光导纤维或普通玻璃等。根据以上分析可知试剂X是铁,其作用是还原三价铁。
(4)由于氢氧化亚铁易被氧化为氢氧化铁,所以白色沉淀迅速转化为灰绿色,最终变为红褐色沉淀,方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(5)由于亚铁离子易被氧化,所以从溶液2中得到绿矾的过程中除需控制温度,防止产品分解外还应注意隔绝空气,防止产品被氧化。
(6)已知1mol绿矾隔绝空气高温煅烧完全分解,转移NA个电子,这说明铁元素化合价从+2价升高到+3价,硫元素化合价从+6价降低到+4价,所以绿矾隔绝空气高温煅烧分解的化学反应方程式为2FeSO4![]() Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。

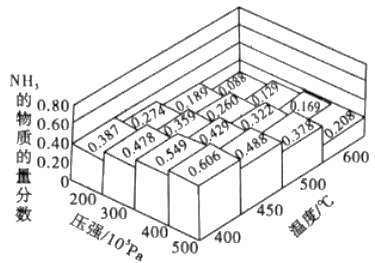
【题目】已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003molL﹣1s﹣1 . ,则6s时c(A)= molL﹣1 , C的物质的量为mol;若反应经一段时间后,达到平衡时A的转化率为 , 如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为;
(3)判断该反应是否达到平衡的依据为(填正确选项前的字母): a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为 .