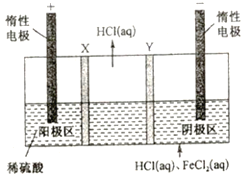
题目内容
【题目】下列有关晶体的叙述中,不正确的是( )
A.氯化钠和氯化铯晶体中,阳离子的配位数均为6
B.金刚石为三维网状结构,由碳原子以sp3杂化轨道形成共价键
C.金属钠的晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
【答案】A
【解析】解:A、氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8,则氯化钠和氯化铯晶体中氯离子的配位数不相同,故A错误;
B、金刚石为三维网状结构,一个碳与四个碳原子形成共价键,所以碳原子以sp3杂化,故B正确;
C、金属钠的晶体采用体心立方堆积,所以每个晶胞含1+8× ![]() 个原子,每个钠原子周围距离最近的钠原子有8个,所以配位数为8,故C正确;
个原子,每个钠原子周围距离最近的钠原子有8个,所以配位数为8,故C正确;
D.采用沿X、Y、Z三轴切割的方法判断二氧化碳分子的个数为12,所以在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子,故D正确;
故选A.
【考点精析】通过灵活运用离子晶体和原子晶体,掌握离子间通过离子键结合而成的晶体叫作离子晶体;相邻原子间以共价键相结合而形成空间网状结构的晶体叫原子晶体即可以解答此题.

【题目】用标准NaOH溶液滴定充满HCl的烧瓶(标况下)做完喷泉实验后得到的稀盐酸,以测定它的准确浓度,请你回答下列问题:
(1)理论计算该盐酸的物质的量浓度为:________________________________。
(2)若用甲基橙作指示剂,达到满定终点时的现象是___________________________。
(3)现有三种浓度的标准NaOH溶液,你认为最合适的是下列第__________种。
①5.00mol·L-1 ②0.500mol·L-1 ③0.0500mol·L-1
(4)若采用上述最合适浓度的标准NaOH溶液满定,滴定时实验数据列表如下:
实验次数编号 | 待测盐酸体积(mL) | 滴入NaOH溶液体积(mL) |
1 | 10.00 | 8.48 |
2 | 10.00 | 8.52 |
3 | 10.00 | 8.00 |
求这种待测稀盐酸的物质的量浓度c(HCl)=___________________。
(5)在滴定操作过程中,以下各项操作使测定值偏高的有:_______________
①滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗
②滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡
③滴定前平视,滴定终了俯视
④看到颜色变化后立即读数
⑤洗涤锥形瓶时,误把稀食盐水当做蒸馏水进行洗涤
【题目】已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003molL﹣1s﹣1 . ,则6s时c(A)= molL﹣1 , C的物质的量为mol;若反应经一段时间后,达到平衡时A的转化率为 , 如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为;
(3)判断该反应是否达到平衡的依据为(填正确选项前的字母): a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为 .