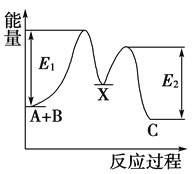
��Ŀ����
����Ŀ����ijһ�¶��£�ijһ�ܱ������У�M��N��R��������Ũ�ȵı仯��ͼa��ʾ���������������䣬���¶ȷֱ�ΪT1��T2ʱ��N�����������ʱ���ϵ��ͼb��ʾ�������н�����ȷ���ǣ������� 
A.�÷�Ӧ���Ȼ�ѧ����ʽM��g��+3N��g��2R��g����H��0
B.�ﵽƽ����������������䣬��С���������ƽ�����淴Ӧ�����ƶ�
C.�ﵽƽ����������������䣬�����¶ȣ������淴Ӧ�ٶȾ�����M��ת���ʼ�С
D.�ﵽƽ����������������䣬ͨ��ϡ�����壬ƽ��һ��������Ӧ�����ƶ�
���𰸡�C
���������⣺A����ͼa�ɵó�M��NΪ��Ӧ�RΪ������ɡ�c֮�ȿ�֪��ѧ������֮�ȣ��÷�ӦΪM��g��+3N��g��2R��g������ͼb��Ҳ����T1��T2�������¶ȣ�N������������ƽ�������ƶ����ʸ÷�ӦΪ���ȷ�Ӧ����H��0����A����
B����С�����������������ѹǿ��ƽ�������ƶ�����B����
C�������¶ȣ�v����v��������ƽ�������ƶ���M��ת���ʼ�С����C��ȷ��
D�������ں��º��ݵ�������ͨ��ϡ�����壬��ƽ�ⲻ�ƶ�����D����
��ѡC��
A����ͼb��Ҳ����T1��T2�������¶ȣ�N������������
B����С�����������������ѹǿ��
C�������¶ȣ�v����v��������ƽ�������ƶ���
D������ʱ��ͨ��ϡ�����壬M��N��R��Ũ�Ȳ��䣮

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�����Ŀ����֪A��g��+B��g��C��g��+D��g����Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
�¶�/�� | 700 | 900 | 830 | 1000 | 1200 |
ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
�ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK= �� ��H0���������������=������
��2��830��ʱ����һ��5L���ܱ������г���0.20mol��A��0.80mol��B���練Ӧ��ʼ6s��A��ƽ����Ӧ����v��A��=0.003molL��1s��1 �� ����6sʱc��A��= molL��1 �� C�����ʵ���Ϊmol������Ӧ��һ��ʱ��ﵽƽ��ʱA��ת����Ϊ �� �����ʱ����ܱ��������ٳ���1mol�����ƽ��ʱA��ת����Ϊ��
��3���жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ������ȷѡ��ǰ����ĸ���� a��ѹǿ����ʱ��ı� b��������ܶȲ���ʱ��ı�
c��c��A������ʱ�ʸı� d����λʱ��������c��D�����ʵ������
��4��1200��ʱ��ӦC��g��+D��g��A��g��+B��g����ƽ�ⳣ����ֵΪ ��
����Ŀ��ij��ѧ��ȤС��Ҫ����к��ȵIJⶨ���ش��������⣺
��1��ʵ�����ϱ��д�С�����ձ�����ĭ���ϡ���ĭ���ϰ塢��ͷ�ιܡ����β����������0.5molL��1���ᡢ0.55molL��1NaOH��Һ��ʵ����ȱ�ٵIJ�����Ʒ�� ��
��2����֪����Ӧ����Һ�ı�����cΪ4.18J����1g��1 �� 0.5molL��1�����0.55molL��1NaOH��Һ���ܶȾ�Ϊ1gcm��3 �� ʵ��ʱ��¼��ʵ�����������
ʵ�� | ��Ӧ�P���� | �� Һ �� �� | ||
t1 | t2 | |||
1 | 50mL0.55molL��1NaOH��Һ | 50mL.0.5molL��1HCl��Һ | 20�� | 23.3�� |
2 | 50mL0.55molL��1NaOH��Һ | 50mL.0.5molL��1HCl��Һ | 20�� | 23.5�� |
��������������Ʒ�Ӧ���к��ȡ�H1=��������λС����
����֪��CH3COOH��aq��CH3COO����aq��+H+��aq����H2��0��
CH3COOH��aq��+OH����aq��=CH3COO����aq��+H20��l����H3 ���H3��H1�������������������=����