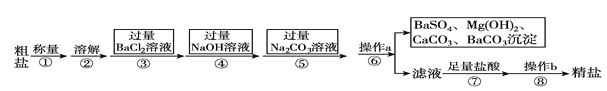
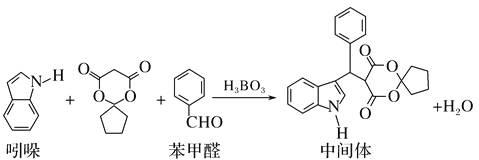
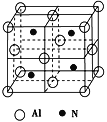
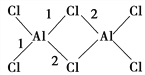
题目内容
【题目】将0.2 mol MnO2和50 mL 12 mol/L盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发)
A. 等于0.3 mol B. 小于0.3 mol
C. 大于0.3 mol D. 以上结论都不正确
【答案】C
【解析】
MnO2只与浓盐酸反应生成氯气和氯化锰,随着盐酸浓度的降低,HCl的还原性减弱,反应停止,以此解答该题。
反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,n(MnO2)=0.2mol,n(HCl)=0.05L×12mol/L=0.6mol;根据方程式可以知道0.2 mol MnO2反应需要HCl为0.2×4=0.8mol>0.6mol ,故MnO2过量,如盐酸完全反应,则生成氯气为0.6mol×1/4=0.15mol,溶液剩余Cl-为0.6mol-0.15mol×2=0.3mol,但MnO2只与浓盐酸反应生成氯气和氯化锰,随着盐酸浓度的降低,HCl的还原性减弱,反应停止,所以溶液中溶液剩余 Cl-大于0.3 mol ;所以,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量大于0.3mol,小于0.6 mol ;
MnCl2+Cl2↑+2H2O,n(MnO2)=0.2mol,n(HCl)=0.05L×12mol/L=0.6mol;根据方程式可以知道0.2 mol MnO2反应需要HCl为0.2×4=0.8mol>0.6mol ,故MnO2过量,如盐酸完全反应,则生成氯气为0.6mol×1/4=0.15mol,溶液剩余Cl-为0.6mol-0.15mol×2=0.3mol,但MnO2只与浓盐酸反应生成氯气和氯化锰,随着盐酸浓度的降低,HCl的还原性减弱,反应停止,所以溶液中溶液剩余 Cl-大于0.3 mol ;所以,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量大于0.3mol,小于0.6 mol ;
综上所述,本题选C。

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目