题目内容
【题目】含卤族元素的化合物在科研和生产中有许多重要用途。如:2molSb(CH3)3、2mol Sb (CH3)2Br和2 molSb(CH3)Br2进行重组反应可生成空间位阻最小的离子化合物[Sb2(CH3)5]2[Sb2(CH3)2Br6]。请回答:
(1)  中,H、C、Br的电负性由大到小的顺序为________,溴原子的M能层电子排布式为________。
中,H、C、Br的电负性由大到小的顺序为________,溴原子的M能层电子排布式为________。
(2)[Sb2(CH3)5]+的结构式为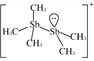 ,Sb原子的杂化轨道类型为_________。写出一种与CH
,Sb原子的杂化轨道类型为_________。写出一种与CH![]() 互为等电子体的阳离子_________。
互为等电子体的阳离子_________。
(3)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于发生I-+I2![]() I
I![]() 。I
。I![]() 离子的空间构型为__________。
离子的空间构型为__________。
(4)一定条件下SbCl3与GaCl3以物质的量之比为l:l混合得到一种固态离子化合物,其结构组成可能为:(a)[SbCl![]() ][GaCl
][GaCl![]() ]或(b)[GaCl
]或(b)[GaCl![]() ][SbCl
][SbCl![]() ],该离子化合物最可能的结构组成为________ (填“a”或“b”),理由是_____________________________。
],该离子化合物最可能的结构组成为________ (填“a”或“b”),理由是_____________________________。
(5)固态PCl5结构中存在PCl![]() 和PCl
和PCl![]() 两种离子,其晶胞如图所示。
两种离子,其晶胞如图所示。
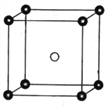
已知晶胞的边长为a nm,阿伏加德罗常数值用NA表示。则PCl![]() 和PCl
和PCl![]() 之间的最短距离为_______pm,固态PCl5的密度为______gcm-3。
之间的最短距离为_______pm,固态PCl5的密度为______gcm-3。
【答案】 Br>C>H 3s23p63d10 sp3杂化 H3O+ 直线形 a GaCl3分子中,Ga原子周围价层电子对数为3,是电子对的接受体,更容易与Cl—上的孤电子对结合,形成配位键,构成[GaCl4—]离子,因此可能结构应是[SbCl2+][GaCl4—] ![]() a×103
a×103 ![]()
【解析】(1)元素的非金属性越强,电负性数值越大,H、C、Br的电负性由大到小的顺序为Br>C>H;溴原子的M能层排满了电子,电子排布式为3s23p63d10,故答案为:Br>C>H;3s23p63d10;
(2)根据[Sb2(CH3)5]+的结构式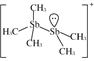 可知,Sb原子的价层电子对数均=4,采用sp3杂化;与CH3-互为等电子体的阳离子为H3O+,故答案为:sp3杂化;H3O+;
可知,Sb原子的价层电子对数均=4,采用sp3杂化;与CH3-互为等电子体的阳离子为H3O+,故答案为:sp3杂化;H3O+;
(3)I3-离子的中心原子I的价层电子对数=2+![]() (7+1-1×2)=5,根据价层电子对互斥理论知,该微粒价层电子对个数是5且含有3个孤电子对,所以其空间构型为直线形,故答案为:直线形;
(7+1-1×2)=5,根据价层电子对互斥理论知,该微粒价层电子对个数是5且含有3个孤电子对,所以其空间构型为直线形,故答案为:直线形;
(4)[SbCl2+]中Sb的价层电子对数=2+![]() (5-1+2×1)=3,[GaCl2+]中Ga的价层电子对数=2+
(5-1+2×1)=3,[GaCl2+]中Ga的价层电子对数=2+![]() (3-1+2×1)=2;[SbCl2+][GaCl4-]中阳离子Sb呈+3价属合N族元素价键规律,阴离子Ga有三个电子与三个Cl原子形成三个共用电子对后还有一个空P轨道,可以结合一个氯离子形成8电子稳定结构;[GaCl2+][SbCl4-]中阳离子镓呈正三价属合第IIIA族元素价键规律,但是阴离子中Sb原子周围却有9个电子,比8电子稳定结构多一个电子,故不稳定,因此结构应是[SbCl2+][GaCl4-],故答案为:a;GaCl3分子中,Ga原子周围价层电子对数为3,是电子对的接受体,更容易与Cl—上的孤电子对结合,形成配位键,构成[GaCl4—]离子,因此可能结构应是[SbCl2+][GaCl4—];
(3-1+2×1)=2;[SbCl2+][GaCl4-]中阳离子Sb呈+3价属合N族元素价键规律,阴离子Ga有三个电子与三个Cl原子形成三个共用电子对后还有一个空P轨道,可以结合一个氯离子形成8电子稳定结构;[GaCl2+][SbCl4-]中阳离子镓呈正三价属合第IIIA族元素价键规律,但是阴离子中Sb原子周围却有9个电子,比8电子稳定结构多一个电子,故不稳定,因此结构应是[SbCl2+][GaCl4-],故答案为:a;GaCl3分子中,Ga原子周围价层电子对数为3,是电子对的接受体,更容易与Cl—上的孤电子对结合,形成配位键,构成[GaCl4—]离子,因此可能结构应是[SbCl2+][GaCl4—];
(5)根据图示,则PCl4+和PCl6-之间的最短距离为体对角线长度的一半=![]() a×103 pm;
a×103 pm;
由晶胞结构可知,PCl4+和PCl6-的数目分别为8×![]() =1和1,则晶胞质量为
=1和1,则晶胞质量为![]() g,晶胞边长为a nm,则晶胞密度
g,晶胞边长为a nm,则晶胞密度![]() g÷(a×10-7cm)3=
g÷(a×10-7cm)3=![]() g/cm3,故答案为:
g/cm3,故答案为: ![]() a×103;
a×103; ![]()