题目内容
【题目】I.实验室用下图装置制取并研究SO2的性质。
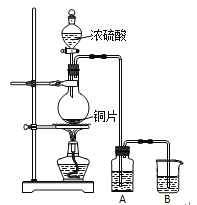
完成下列填空:
(1)圆底烧瓶中反应的化学方程式为_____________________________________。
(2)若A中盛放品红溶液,可以验证的SO2性质是______________。若要验证SO2的还原性,A中应盛放_________溶液。B中应盛放_________溶液。
II.为测定反应后的溶液中残留的硫酸浓度,实验小组进行如下探究。
(3)甲组:取1 mL反应液加水稀释至100 mL,再取10 mL稀释液与足量锌粒用下图装置进行测定。在读取反应前后量气管中液面读数时应先调节水准管与量气管中液面等高,这样操作的目的是________。
实验测得反应生成的氢气体积为22.4 mL(已换算到标准状况),计算原反应液中残留的硫酸浓度为______mol/L。

(4)乙组:欲通过加入足量的BaCl2溶液,测定生成的BaSO4沉淀质量来达到实验目的。该设计思路不可行,理由是_______________________________。
【答案】 Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O 漂白性 溴水(或高锰酸钾溶液) 氢氧化钠 使量气管内压强与大气压一致 10 mol/L 反应液中除了硫酸,还有硫酸铜,也会与氯化钡反应生成硫酸钡沉淀,所以不能通过沉淀的质量计算硫酸的质量
CuSO4+SO2↑+2H2O 漂白性 溴水(或高锰酸钾溶液) 氢氧化钠 使量气管内压强与大气压一致 10 mol/L 反应液中除了硫酸,还有硫酸铜,也会与氯化钡反应生成硫酸钡沉淀,所以不能通过沉淀的质量计算硫酸的质量
【解析】(1)圆底烧瓶中铜与浓硫酸反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。(2)若A中盛放品红溶液,可以验证的SO2性质是漂白性。若要验证SO2的还原性,A中应盛放酸性高锰酸钾溶液或溴水。二氧化硫有毒,需要尾气处理,则B中应盛放氢氧化钠溶液。(3)由于气体的体积受温度、压强影响大,因此在读取反应前后量气管中液面读数时应先调节水准管与量气管中液面等高的目的是使量气管内压强与大气压一致。氢气的物质的量是0.001mol,根据氢原子守恒可知硫酸的物质的量是0.001mol,则其浓度是0.001mol÷0.01L=0.1mol/L,所以浓硫酸的浓度是0.1mol/L×100=10mol/L;(4)由于反应液中除了硫酸,还有硫酸铜,也会与氯化钡反应生成硫酸钡沉淀,所以不能通过沉淀的质量计算硫酸的质量。
CuSO4+SO2↑+2H2O。(2)若A中盛放品红溶液,可以验证的SO2性质是漂白性。若要验证SO2的还原性,A中应盛放酸性高锰酸钾溶液或溴水。二氧化硫有毒,需要尾气处理,则B中应盛放氢氧化钠溶液。(3)由于气体的体积受温度、压强影响大,因此在读取反应前后量气管中液面读数时应先调节水准管与量气管中液面等高的目的是使量气管内压强与大气压一致。氢气的物质的量是0.001mol,根据氢原子守恒可知硫酸的物质的量是0.001mol,则其浓度是0.001mol÷0.01L=0.1mol/L,所以浓硫酸的浓度是0.1mol/L×100=10mol/L;(4)由于反应液中除了硫酸,还有硫酸铜,也会与氯化钡反应生成硫酸钡沉淀,所以不能通过沉淀的质量计算硫酸的质量。

 阅读快车系列答案
阅读快车系列答案