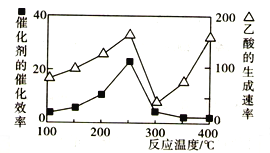
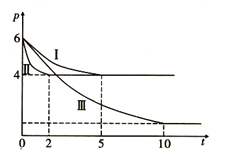
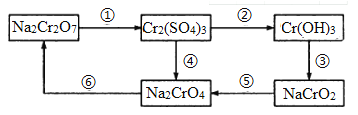
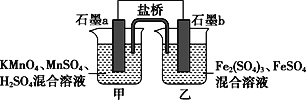
题目内容
【题目】某抗肿瘤药物中间体的合成路线如下。下列说法正确的是( )
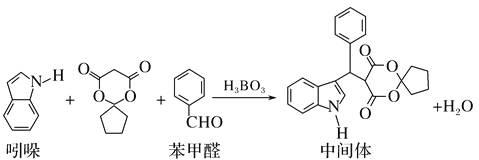
A. 吲哚的分子式为C8H6N
B. 苯甲醛中所有原子不可能全部共平面
C. 可用新制氢氧化铜悬浊液区分苯甲醛和中间体
D. 1mol该中间体,最多可以与9mol氢气发生加成反应
【答案】C
【解析】A、根据有机物中碳原子成键特点,吲哚的分子式为C8H7N,故A错误;B、苯环是平面正六边形,-CHO中C是sp2杂化,空间构型是平面形,因此苯甲醛中所有原子可能全部共面,故B错误;C、苯甲醛中含有醛基,能使新制氢氧化铜悬浊液加热时,出现砖红色沉淀,中间体中不含醛基,加入新制氢氧化铜悬浊液无现象,可用新制氢氧化铜悬浊液区分苯甲醛和中间体,故C正确;D、1mol中间体中含有2mol苯环和1mol碳碳双键,因此1mol中间体最多与7mol氢气发生加成反应,故D错误。

练习册系列答案
相关题目