题目内容
【题目】高锰酸钾和浓盐酸可以发生下列反应:2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O
(1)用双线桥法表示此反应的电子转移的方向及数目_____________
(2)该反应的氧化剂是______,还原剂是________。HCl表现 ___________性和 ____性。
(3)若消耗0.2 mol氧化剂,转移电子的物质的量是________ mol。生成氯气在标准状况下的体积是__________
【答案】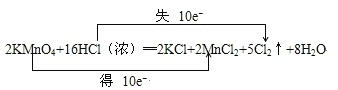 KMnO4 HCl 酸性 还原性 1mol 11.2L
KMnO4 HCl 酸性 还原性 1mol 11.2L
【解析】
(1)反应中KMnO4中Mn元素获得10电子生成MnCl2,HCl中Cl元素失去10电子生成Cl2;双线桥表示方法为化合价变化的同一元素用直线加箭头从反应物指向生成物,并在上方注明“得”或“失”及转移电子数目;
(2)所含元素化合价降低的反应物是氧化剂,所含元素化合价升高的反应物是还原剂;
(3)反应中氯元素化合价由-1价升高为0价,令生成的氯气的物质的量为xmol,根据电子转移列方程计算x的值,并根据方程式分析电子转移的数目。
(1)反应中KMnO4中Mn元素获得10电子生成MnCl2,HCl中Cl元素失去10电子生成Cl2.用双线桥表示出该反应的电子转移情况为: ;综上所述,本题答案是:
;综上所述,本题答案是: 。
。
(2)反应中Mn的化合价由MnO4-中+7价降低为Mn2+中+2价,化合价降低,故KMnO4是氧化剂;氯元素的化合价由HCl中-1价升高为Cl2中0价,故HCl是还原剂,具有还原性;但是16molHCl参与反应,被氧化的只有10mol,还有6 molHCl没有变价,生成了盐,显酸性;综上所述,本题答案是:KMnO4;HCl;酸性;还原性。
(3)根据(1)反应方程式可知:2KMnO4~5Cl2~10e-;若消耗0.2 mol氧化剂,转移电子的物质的量是1 mol;生成氯气的量0.5 mol,在标准状况下的体积是 V=nVm=0.5mol×22.4L/mol=11.2L;综上所述,本题答案是:1mol,11.2L。