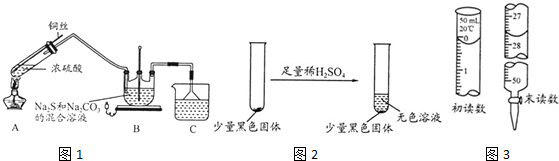
题目内容
14.铵明矾[NH4Al(SO4)2•12H2O]是常见的食品添加剂,用于焙烤食品,可通过硫酸铝溶液和硫酸铵溶液反应制备.用芒硝(Na2SO4•10H2O)制备纯碱和铵明矾的生产工艺流程图如图1: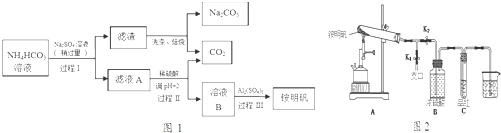
完成下列填空:
(1)铵明矾溶液呈酸性性,它可用于净水,原因是铵明矾溶液电离出的铝离子水解生成氢氧化铝胶体,有吸附作用;向其溶液中逐滴加入NaOH溶液至过量,可观察到的现象是先产生白色沉淀,后产生有刺激性气味的气体,再加入过量的NaOH溶液,白色沉淀逐渐溶解并消失.
(2)写出过程Ⅰ的化学反应方程式2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 .
(3)若省略过程Ⅱ,直接将硫酸铝溶液加入滤液A中,铵明矾的产率会明显降低,原因是省略过程Ⅱ,因HCO3-与Al3+的水解相互促进,产生大量氢氧化铝沉淀,导致铵明矾的产率降低.
(4)已知铵明矾的溶解度随温度升高明显增大.加入硫酸铝后,经过程 III的系列实验得到铵明矾,该系列的操作是加热浓缩、冷却结晶、过滤洗涤、干燥.
(5)某同学用图2图示的装置探究铵明矾高温分解后气体的组成成份.
(a)夹住止水夹K1,打开止水夹K2,用酒精喷灯充分灼烧.实验过程中,装置A和导管中未见红棕色气体;试管C中的品红溶液褪色;在支口处可检验到NH3,方法是打开K1,用蘸有浓盐酸的玻璃棒靠近支口,出现白烟;在装置A与B之间的T型导管中出现白色固体,该白色固体可能是(NH4)2SO3(任填一种物质的化学式);另分析得出装置A试管中残留的白色固体是两性氧化物,写出它溶于NaOH溶液的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(b)该同学通过实验证明铵明矾高温分解后气体的组成成份是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=1:3.
分析 碳酸氢铵溶液中加入硫酸钠,过滤得到滤渣与溶液A,而滤渣焙烧得到碳酸钠与二氧化碳,可知滤渣为NaHCO3,过程I利用溶解度不同发生复分解反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,滤液A中含有(NH4)2SO4 及溶解的NH4HCO3,加入硫酸,调节pH使NH4HCO3转化二氧化碳与(NH4)2SO4 ,得到溶液B为(NH4)2SO4 溶液,再加入硫酸铝得铵明矾.
(1)铵明矾溶液中铝离子水解,溶液呈酸性,得到氢氧化铝胶体,可以用于净水;向溶液中加入氢氧化钠溶液,首先与溶液中铝离子反应生成氢氧化铝沉淀,再与氨气根离子反应生成氨气,再加入过量的NaOH溶液溶解氢氧化铝;
(2)过程I利用溶解度不同发生复分解反应;
(3)HCO3-与Al3+的水解相互促进,产生大量氢氧化铝沉淀;
(4)用于铵明矾的溶解度随温度升高明显增大,从溶液中获得晶体,加热浓缩、冷却结晶、过滤洗涤、干燥;
(5)(a)由题目信息可知有NH3生成,用蘸有浓盐酸的玻璃棒靠近支口检验氨气;装置A和导管中未见红棕色气体,试管C中的品红溶液褪色,说明加热分解有SO2生成,氨气与二氧化硫、水蒸汽反应可以生成(NH4)2SO3;装置A试管中残留的白色固体是两性氧化物,该物质为氧化铝;
(b)根据电子转移守恒确定n(N2):n(SO2),相同条件下气体体积之比等于其物质的量之比.
解答 解:碳酸氢铵溶液中加入硫酸钠,过滤得到滤渣与溶液A,而滤渣焙烧得到碳酸钠与二氧化碳,可知滤渣为NaHCO3,过程I利用溶解度不同发生复分解反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,滤液A中含有(NH4)2SO4 及溶解的NH4HCO3,加入硫酸,调节pH使NH4HCO3转化二氧化碳与(NH4)2SO4 ,得到溶液B为(NH4)2SO4 溶液,再加入硫酸铝得铵明矾.
(1)铵明矾溶液中铝离子水解:Al3++3H2O?Al(OH)3+3H+,破坏水的电离平衡,溶液呈酸性;水解得到氢氧化铝胶体,可以吸附悬浮物质,可以用于净水;向溶液中加入氢氧化钠溶液,首先与溶液中铝离子反应生成氢氧化铝沉淀,再与氨气根离子反应生成氨气,再加入过量的NaOH溶液溶解氢氧化铝,现象为:先产生白色沉淀,后产生有刺激性气味的气体,再加入过量的NaOH溶液,白色沉淀逐渐溶解并消失,
故答案为:酸性;铵明矾溶液电离出的铝离子水解生成氢氧化铝胶体,有吸附作用,故铵明矾能净水;先产生白色沉淀,后产生有刺激性气味的气体,再加入过量的NaOH溶液,白色沉淀逐渐溶解并消失;
(2)过程I利用溶解度不同发生复分解反应,反应方程式为:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,
故答案为:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ;
(3)省略过程Ⅱ,因HCO3-与Al3+的水解相互促进,产生大量氢氧化铝沉淀,导致铵明矾的产率降低,
故答案为:省略过程Ⅱ,因HCO3-与Al3+的水解相互促进,产生大量氢氧化铝沉淀,导致铵明矾的产率降低;
(4)用于铵明矾的溶解度随温度升高明显增大,从溶液中获得晶体,加热浓缩、冷却结晶、过滤洗涤、干燥,
故答案为:冷却结晶;
(5)(a)检验氨气方法为:打开K1,用蘸有浓盐酸的玻璃棒靠近支口,出现白烟;
装置A和导管中未见红棕色气体,试管C中的品红溶液褪色,说明加热分解有SO2生成,氨气与二氧化硫、水蒸汽反应可以生成(NH4)2SO3,白色固体可能是(NH4)2SO3;
装置A试管中残留的白色固体是两性氧化物,该物质为氧化铝,与氢氧化钠溶液反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:打开K1,用蘸有浓盐酸的玻璃棒靠近支口,出现白烟;(NH4)2SO3;Al2O3+2OH-=2AlO2-+H2O;
(b)根据电子转移守恒:2×[0-(-3)]×n(N2)=n(SO2)×(6-4),故n(N2):n(SO2)=1:3,相同条件下气体体积之比等于其物质的量之比,故V(N2):V(SO2)=1:3,
故答案为:1:3.
点评 本题考查制备实验方案设计、物质组成的测定,明确工艺流程原理是解题关键,综合考查学生分析解决问题的能力,难度中等.

| A. | 任何化学反应,只要是放热反应,理论上都能设计成原电池 | |
| B. | 原子结合成分子过程中一般释放出能量 | |
| C. | 周期表中所有元素都是从自然界中发现的 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
| A. | 化学反应速率通常用单位时间内反应物或生成物的物质的量浓度变化来表示 | |
| B. | 化学反应速率是衡量化学反应进行快慢程度的物理量 | |
| C. | 用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比 | |
| D. | 若某化学反应的反应速率为0.5mol/(L•s),就是指在1s内反应物和生成物的浓度变化都为0.5mol/L |
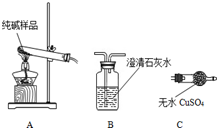 某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:(1)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
| 选择的装置 (填编号) | 实验现象 | 实验结论 |
| AB或AC或ACB | B变浑浊或C变蓝或C变蓝、B变浑 | 样品含 NaHCO3 |
(3)该小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去.为探究原因,进行了下列实验:
实验1:加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
| 温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
实验2:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,澄清石灰水变浑浊.
①用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-.这两个平衡以水解平衡为主.
②结合实验1、2分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是NaHCO3分解生成Na2CO3,碱性增强(答一条).

| A. | 起始滤液常温下pH=7 | B. | 试剂Ⅰ为 Ba(NO3)2溶液 | ||
| C. | 上图过程须经2次过滤 | D. | 步骤③目的是除去 CO32- |
| A. | 青铜、不锈钢和硬铝都是合金 | |
| B. | 铝是活泼金属,但在空气中耐腐蚀 | |
| C. | MgO可以与Al组成铝热剂,进行铝热反应 | |
| D. | 铜锈的主要成分是Cu2(OH)2CO3,可以用稀盐酸除铜锈 |