题目内容
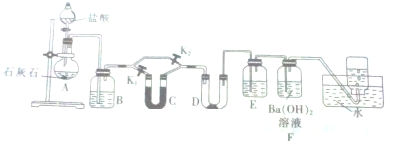
2.Na2S2O3•5H2O在化学定量分析中常用作基准物质,实验室制备原理为:2Na2S+Na2CO3+4SO2$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S2O3+CO2.设计如图1装置(夹持仪器省略)进行实验.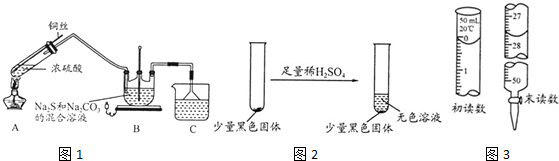
(1)A中发生的化学反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)C中所盛试剂可能是NaOH溶液;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是将铜丝抽离液面停止反应;
(3)学生乙在加热A后,发现液面下的铜丝变黑如2.对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是Cu2O为砖红色;
该生用如下实验进一步验证黑色物质的组成:基于上述假设分析,黑色物质的组成为CuS(填化学式).
(4)实验室用Na2S2O3标准液测量某工业废水中的I2的浓度.
已知:2S2O32-+I2=S4O62-+2I-.
①以淀粉为指示剂,则到达滴定终点的现象是滴入最后一滴,溶液由蓝色变为无色,且半分钟内不变色;
②若标液Na2S2O3的浓度0.0030mol•L-1,滴定25.00mL工业废水消耗该Na2S2O3溶液体积如右图所示,则该废水中I2的浓度为0.0014mol/L.
分析 (1)加热条件下,Cu和浓硫酸反应生成CuSO4、SO2和H2O;
(2)SO2有毒,不能直接排空,且为酸性氧化物,能和碱溶液反应生成无毒亚硫酸盐;还可以将Cu和浓硫酸分离而停止反应;
(3)Cu2O呈砖红色;CuO能溶于稀硫酸生成蓝色CuSO4溶液,黑色固体CuS不溶于稀硫酸;
(4)①碘遇淀粉试液变蓝色;
②V(Na2S2O3)=(27.60-0.10)mL,根据该反应中2S2O32-----I2计算碘的物质的量浓度.
解答 解:(1)加热条件下,Cu和浓硫酸反应生成CuSO4、SO2和H2O,反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)SO2有毒,不能直接排空,且为酸性氧化物,能和碱溶液反应生成无毒亚硫酸盐,所以可以碱液吸收二氧化硫尾气,如NaOH溶液;还可以将Cu和浓硫酸分离而停止反应,
故答案为:NaOH溶液;将铜丝抽离液面停止反应;
(3)Cu2O为砖红色不是黑色,所以②一定不成立;CuO能溶于稀硫酸生成蓝色CuSO4溶液,黑色固体CuS不溶于稀硫酸,所以该黑色固体是CuS,
故答案为:Cu2O为砖红色;CuS;
(4)①碘遇淀粉试液变蓝色,如果滴入最后一滴,溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点,故答案为:滴入最后一滴,溶液由蓝色变为无色,且半分钟内不变色;
②V(Na2S2O3)=(27.60-0.10)mL=27.50mL,设碘的物质的量浓度是xmol/L,
I2------2S2O32-
1mol 2mol
0.0275xmol (0.025×0.0030)mol
1mol:2mol=0.0275xmol:(0.025×0.0030)mol
x=$\frac{(0.025×0.0030)mol×1mol}{2mol×0.0275mol}$=0.0014,
故答案为:0.0014mol/L.
点评 本题考查性质实验方案设计,涉及离子方程式的计算、氧化还原反应、物质判断等知识点,侧重考查学生分析判断及计算能力,注意滴定管读数方法,题目难度不大.

 优生乐园系列答案
优生乐园系列答案| A. | 催化剂 | B. | 温度、压强以及反应物的接触面 | ||
| C. | 反应物的浓度 | D. | 参加反应的物质本身的性质 |
 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:(1)甲同学运用沉淀法测定样品中NaOH的含量.甲同学选用的药品除样品外,还应有氯化钡溶液,实验中应测定的数据有样品质量和沉淀的质量.
(2)乙同学运用滴定法测定样品中NaOH的含量.
①用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液.用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂.用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色变化.滴定终点的现象是由黄色变成橙色,且半分钟不褪色.
②下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D(填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
③若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0mL,终点读数26.10mL;
(3)某学生根据三次实验分别记录有关数据如下:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 20.00 | 0.00 | 26.01 |
| 第二次 | 20.00 | 1.56 | 30.30 |
| 第三次 | 20.00 | 0.22 | 26.21 |
 25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1
25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1 mol•L-1NaOH溶液,溶液pH变化如图所示.此过程中
下列说法正确的是(溶液混合忽略体积变化)( )
| A. | a点:c(CH3COO-)<c(Na+) | |
| B. | 水的电离程度:c点小于d点 | |
| C. | b点时,NaoH和CH3COOH恰好完全反应 | |
| D. | d点:c(OH-)-c(H+)+c(CH3COOH)=0.2 mol•L-1 |
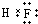 ;A的最高价氧化物对应水化物的化学式为HNO3.
;A的最高价氧化物对应水化物的化学式为HNO3.