题目内容
4.为测定一种气态烃的化学式,取一定量的A置于密闭容器中燃烧,定性实验表明产物是CO2,CO和水蒸气.学生甲、乙设计了如下两个方案,均认为根据自己的方案能求出A的最简式.他们测得的有关数据如下(图中的箭头表示气体的流向,实验前系统内的空气已排除):甲方案

乙方案
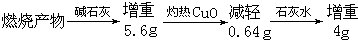
试回答:
(1)请选出你认为合理的实验方案甲.(填“甲”、“乙”或“甲、乙均可”)
(2)若要确定A的分子式,是否还需要测定其它数据?否.(填“是”、或“否”),如果需要,该测定哪些数据?最简式CH4,C:H=1:4只有甲烷.(上空若填“否”,此空不填),如果不需要,请说明理由-.
分析 (1)甲中浓硫酸吸收的是水、碱石灰吸收的是二氧化碳,最终CO燃烧生成二氧化碳,可以根据二者计算H、C原子个数比;乙中碱石灰吸收水和二氧化碳,CO还原CuO得到二氧化碳,但不能根据碱石灰增加的质量计算出C、H原子个数比;
(2)浓硫酸吸收水的物质的量=$\frac{2.52g}{18g/mol}$=0.14mol,碱石灰吸收二氧化碳的物质的量=$\frac{1.32g}{44g/mol}$=0.03mol,CO燃烧生成二氧化碳物质的量=$\frac{1.76g}{44g/mol}$=0.04mol,则二氧化碳分子个数和水中H原子个数之比为0.07mol:0.028mol=1:4,根据C、H原子个数比及状态判断物质;C、H原子个数被1:4,每个C原子最多形成4个C-H键.
解答 解:(1)甲中浓硫酸吸收的是水、碱石灰吸收的是二氧化碳,最终CO燃烧生成二氧化碳,可以根据水的物质的量、二氧化碳的物质的量计算H、C原子个数比,从而确定该物质化学式;
乙中碱石灰吸收水和二氧化碳,剩余的CO还原CuO得到二氧化碳,但不能根据碱石灰增加的质量计算出C、H原子个数比,所以乙不能确定该物质的最简式;
则甲可以求出A的最简式、乙不能求出A的最简式,
故答案为:甲;
(2)浓硫酸吸收水的物质的量=$\frac{2.52g}{18g/mol}$=0.14mol,碱石灰吸收二氧化碳的物质的量=$\frac{1.32g}{44g/mol}$=0.03mol,
CO燃烧生成二氧化碳物质的量=$\frac{1.76g}{44g/mol}$=0.04mol,
则二氧化碳分子个数和水中H原子个数之比为0.07mol:0.28mol=1:4,其最简式为CH4,C、H原子个数被1:4,每个C原子最多形成4个C-H键,最简式中,H的含量已经达到最大值,所以不用测定其它数据,故答案为:否; 因为最简式中,H的含量已经达到最大值
故答案为:否;最简式CH4,C:H=1:4只有甲烷.
点评 本题考查有机物结构与性质、有机物分子式、结构简式的确定,题目难度中等,明确浓硫酸、碱石灰的性质是解本题关键,知道有机物中C原子成键特点.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案单质$\stackrel{+O2}{→}$氧化物$\stackrel{+H2O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐.
| A. | 铜 | B. | 铝 | C. | 铁 | D. | 钠 |
 25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1
25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1 mol•L-1NaOH溶液,溶液pH变化如图所示.此过程中
下列说法正确的是(溶液混合忽略体积变化)( )
| A. | a点:c(CH3COO-)<c(Na+) | |
| B. | 水的电离程度:c点小于d点 | |
| C. | b点时,NaoH和CH3COOH恰好完全反应 | |
| D. | d点:c(OH-)-c(H+)+c(CH3COOH)=0.2 mol•L-1 |
| A. | C2H4 | B. | Br2 | C. | Na2O2 | D. | CH3COOH |
(1)E3+的核外有5个未成对电子,A2C2的电子式为
 .
.(2)F(BC)n的中心原子价电子数与配体提供电子总数之和为18,则n=4.
(3)B的一种氢化物分子中共有14个价电子,该分子中存在的共价键类型有ABFG.(填代号)
A.非极性键 B.极性键 C. s-sσ键 D.s-pσ键
E.p-pπ键 F.s-sp3σ键 G.sp3-sp3σ键H.sp3-sp3 π键
(4)A2D和A2C2的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| A2D | 187 | 202 | 2.6 |
| A2C2 | 272 | 423 | 以任意比互溶 |
| A. | $\frac{A-N-n}{aA}$ mol | B. | $\frac{a(A-N)}{A}$ mol | C. | $\frac{m(A-N-n)}{A}$ mol | D. | $\frac{a(A-N+n)}{A}$ mol |
 合成氨是人类科学技术上的一项重大突破,其反应原理为:
合成氨是人类科学技术上的一项重大突破,其反应原理为: