题目内容
3.下列有关金属的说法中,不正确的是( )| A. | 青铜、不锈钢和硬铝都是合金 | |
| B. | 铝是活泼金属,但在空气中耐腐蚀 | |
| C. | MgO可以与Al组成铝热剂,进行铝热反应 | |
| D. | 铜锈的主要成分是Cu2(OH)2CO3,可以用稀盐酸除铜锈 |
分析 A.青铜为Cu的合金,不锈钢为Fe的合金,硬铝为Al的合金;
B.铝是活泼金属,在空气中氧化生成致密的氧化膜;
C.Mg比Al活泼,MgO与Al不反应;
D.盐酸与Cu2(OH)2CO3反应,与Cu不反应.
解答 解:A.青铜为Cu的合金,不锈钢为Fe的合金,硬铝为Al的合金,则青铜、不锈钢和硬铝都是合金,故A正确;
B.铝是活泼金属,在空气中氧化生成致密的氧化膜,则在空气中耐腐蚀,故B正确;
C.Mg比Al活泼,MgO与Al不反应,则不能进行铝热反应,故C错误;
D.铜锈的主要成分是Cu2(OH)2CO3,盐酸与Cu2(OH)2CO3反应,与Cu不反应,则可以用稀盐酸除铜锈,故D正确;
故选C.
点评 本题考查金属的性质,为高频考点,把握金属及化合物的性质、发生的反应、性质与用途的关系等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
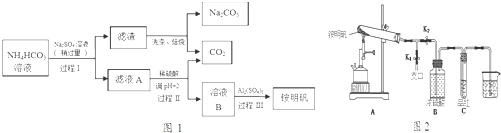
11. 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
(1)甲同学运用沉淀法测定样品中NaOH的含量.甲同学选用的药品除样品外,还应有氯化钡溶液,实验中应测定的数据有样品质量和沉淀的质量.
(2)乙同学运用滴定法测定样品中NaOH的含量.
①用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液.用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂.用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色变化.滴定终点的现象是由黄色变成橙色,且半分钟不褪色.
②下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D(填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
③若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0mL,终点读数26.10mL;
(3)某学生根据三次实验分别记录有关数据如下:
请选用其中合理的数据列式计算出该样品中NaOH的质量百分含量.(写出计算过程)
 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:(1)甲同学运用沉淀法测定样品中NaOH的含量.甲同学选用的药品除样品外,还应有氯化钡溶液,实验中应测定的数据有样品质量和沉淀的质量.
(2)乙同学运用滴定法测定样品中NaOH的含量.
①用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液.用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂.用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色变化.滴定终点的现象是由黄色变成橙色,且半分钟不褪色.
②下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D(填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
③若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0mL,终点读数26.10mL;
(3)某学生根据三次实验分别记录有关数据如下:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 20.00 | 0.00 | 26.01 |
| 第二次 | 20.00 | 1.56 | 30.30 |
| 第三次 | 20.00 | 0.22 | 26.21 |
18.乙醇分子中不同的化学键如图所示,下列不同反应中键的断裂不正确的是( )


| A. | 和乙酸发生酯化反应键a断裂 | |
| B. | 和氢溴酸反应键a断裂 | |
| C. | 在铜催化和加热条件下和氧气反应键a、c断裂 | |
| D. | 和浓硫酸共热至170℃时键b和d断裂 |
8.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ne(填具体元素符号);非金属性最强的元素是F(填具体元素符号),原子结构示意图为 .元素⑩名称为溴.
.元素⑩名称为溴.
(2)在这些元素最高价氧化物对应的水化物中,酸性最强是HClO4(填化学式)
(3)⑦的单质能与NaOH溶液反应,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)在这些元素中,最高价氧化物对应的水化物能与其气态氢化物化合生成盐的元素是②(填编号)
(5)⑥⑦⑧⑨四种元素对应的简单离子中,离子半径最小的是Al3+(填离子符号)
(6)⑧和⑨都是重要的非金属元素.下列叙述中,能说明⑨的非金属性比⑧强的是bc
a.氢化物的沸点:⑨>⑧
b.⑨的单质与氢气化合比⑧的单质容易
c.⑨的单质可置换出⑧的单质
d.⑨的氢化物的酸性比⑧的氢化物的酸性强.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 4 | ⑩ |
 .元素⑩名称为溴.
.元素⑩名称为溴.(2)在这些元素最高价氧化物对应的水化物中,酸性最强是HClO4(填化学式)
(3)⑦的单质能与NaOH溶液反应,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)在这些元素中,最高价氧化物对应的水化物能与其气态氢化物化合生成盐的元素是②(填编号)
(5)⑥⑦⑧⑨四种元素对应的简单离子中,离子半径最小的是Al3+(填离子符号)
(6)⑧和⑨都是重要的非金属元素.下列叙述中,能说明⑨的非金属性比⑧强的是bc
a.氢化物的沸点:⑨>⑧
b.⑨的单质与氢气化合比⑧的单质容易
c.⑨的单质可置换出⑧的单质
d.⑨的氢化物的酸性比⑧的氢化物的酸性强.
15.能实现下列物质间直接转化的元素是( )
单质$\stackrel{+O2}{→}$氧化物$\stackrel{+H2O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐.
单质$\stackrel{+O2}{→}$氧化物$\stackrel{+H2O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐.
| A. | 铜 | B. | 铝 | C. | 铁 | D. | 钠 |
12. 25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1
25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1
mol•L-1NaOH溶液,溶液pH变化如图所示.此过程中
下列说法正确的是(溶液混合忽略体积变化)( )
 25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1
25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1 mol•L-1NaOH溶液,溶液pH变化如图所示.此过程中
下列说法正确的是(溶液混合忽略体积变化)( )
| A. | a点:c(CH3COO-)<c(Na+) | |
| B. | 水的电离程度:c点小于d点 | |
| C. | b点时,NaoH和CH3COOH恰好完全反应 | |
| D. | d点:c(OH-)-c(H+)+c(CH3COOH)=0.2 mol•L-1 |
13.已知阴离子X n-含有N个中子,元素X的质量数为A,则a g Xn- 中含电子的物质的量是( )
| A. | $\frac{A-N-n}{aA}$ mol | B. | $\frac{a(A-N)}{A}$ mol | C. | $\frac{m(A-N-n)}{A}$ mol | D. | $\frac{a(A-N+n)}{A}$ mol |
 ;A的最高价氧化物对应水化物的化学式为HNO3.
;A的最高价氧化物对应水化物的化学式为HNO3.