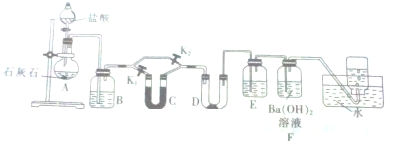
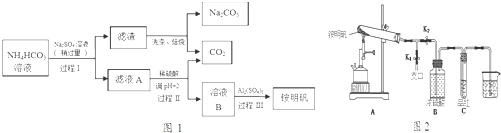
题目内容
9.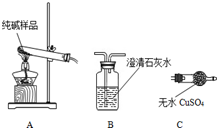 某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:(1)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
| 选择的装置 (填编号) | 实验现象 | 实验结论 |
| AB或AC或ACB | B变浑浊或C变蓝或C变蓝、B变浑 | 样品含 NaHCO3 |
(3)该小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去.为探究原因,进行了下列实验:
实验1:加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
| 温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
实验2:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,澄清石灰水变浑浊.
①用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-.这两个平衡以水解平衡为主.
②结合实验1、2分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是NaHCO3分解生成Na2CO3,碱性增强(答一条).
分析 (1)由于碳酸氢钠加热分解生成碳酸钠、二氧化碳与水,可以利用澄清石灰水检验二氧化碳,或利用无水硫酸铜检验水,判断样品中含有碳酸氢钠;
(2)样品中碳酸钠与氯化钙反应生成碳酸钙沉淀,过滤、洗涤、干燥,称量碳酸钙的质量,根据碳酸钙的质量计算样品中碳酸钠的质量,进而计算该纯碱样品的纯度;
(3)①溶液中碳酸氢根发生电离平衡与水解平衡,由表中数据可知,碳酸氢钠溶液呈碱性,说明碳酸氢根的水解程度大于电离程度;
②实验1加热后再恢复到10℃,测得溶液pH=9.8,溶液碱性增强,实验2中将产生的气体通入澄清石灰水,澄清石灰水变浑浊,有二氧化碳生成,说明加热过程中碳酸氢钠分解为碳酸钠、二氧化碳.
解答 解:(1)由于碳酸氢钠加热分解生成碳酸钠、二氧化碳与水,利用二氧化碳使澄清石灰水变浑浊,或利用无色无水硫酸铜吸水变蓝色,判断样品中含有碳酸氢钠,故选择的装置为:“AB”或“AC”或“ACB”,对应的现象为:“B变浑浊”或“C变蓝”或“C变蓝、B变浑”,
故答案为:AB或AC或ACB;B变浑浊或C变蓝或C变蓝、B变浑;
(2)样品中碳酸钠与氯化钙反应生成碳酸钙沉淀,过滤、洗涤、干燥,称量碳酸钙的质量为m2g,根据碳酸根守恒可知样品中n(碳酸钠)=n(碳酸钙)=$\frac{{m}_{2}g}{100g/mol}$=$\frac{{m}_{2}}{100}$mol,故m(碳酸钠)=n(碳酸钙)=$\frac{{m}_{2}}{100}$mol×106g/mol=$\frac{106{m}_{2}}{100}$g,该纯碱样品的纯度为$\frac{\frac{106{m}_{2}}{100}g}{{m}_{1}}$×100%=$\frac{106{m}_{2}}{{m}_{1}}$%,
故答案为:洗涤;$\frac{106{m}_{2}}{{m}_{1}}$%;
(3)①溶液中碳酸氢根发生电离平衡与水解平衡,对应离子方程式为:HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-,由表中数据可知,碳酸氢钠溶液呈碱性,说明碳酸氢根的水解程度大于电离程度,
故答案为:HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-;水解平衡;
②实验1加热后再恢复到10℃,测得溶液pH=9.8,溶液碱性增强,实验2中将产生的气体通入澄清石灰水,澄清石灰水变浑浊,有二氧化碳生成,说明加热过程中碳酸氢钠分解为碳酸钠、二氧化碳,碳酸钠的水解程度大于碳酸氢钠,溶液碱性增强,
故答案为:NaHCO3分解生成Na2CO3,碱性增强.
点评 本题考查实验方案设计、物质含量的测定、探究实验等,是对基础知识的综合应用、分析解决问题能力的考查,难度中等.

| A. | 丁烷和2,2-二甲基丙烷 | B. |  和 和 | ||
| C. | CH2=CH-CH=CH2和CH3-CH2-C≡CH | D. |  和 和 |

| A. | 和乙酸发生酯化反应键a断裂 | |
| B. | 和氢溴酸反应键a断裂 | |
| C. | 在铜催化和加热条件下和氧气反应键a、c断裂 | |
| D. | 和浓硫酸共热至170℃时键b和d断裂 |

 ,其所含有的官能团有(写结构简式)-$\underset{\stackrel{\;}{C}}{|}=O$、-OH、C=C、-O-.
,其所含有的官能团有(写结构简式)-$\underset{\stackrel{\;}{C}}{|}=O$、-OH、C=C、-O-. .这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究成果.L-多巴分子中所含的官能团的名称是羟基、氨基和羧基.
.这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究成果.L-多巴分子中所含的官能团的名称是羟基、氨基和羧基.