题目内容
6.某有机化合物A含碳77.8%,氢为7.40%,其余为氧,A的相对分子质量为108,求:(1)该有机物的分子式.
(2)红外光谱测定,A分子结构中含有苯环和羟基,能与烧碱反应,且在常温下A可与浓溴水反应,1molA最多可与2molBr2作用,据此确定该有机物的结构简式.
分析 (1)根据各元素的含量确定有机物中各原子的个数,进而确定有机物分子式;
(2)A在常温下A可与浓溴水反应,说明A物质属于酚类,1molA最多可与2molBr2作用,说明羟基和甲基处于邻位或对位.
解答 解:(1)已知:M(A)=108,则有:
N(C)=$\frac{108×77.8%}{12}$=7,
N(H)=$\frac{108×7.4%}{1}$=8,
N(O)=$\frac{108×(1-77.8%-7.4%)}{16}$=1,
所以,A的分子式为C7H8O,
答:有机物的分子式为C7H8O;
(2)A在常温下A可与浓溴水反应,说明A物质属于酚类,1molA最多可与2molBr2作用,说明羟基和甲基处于邻位或对位,则A的可能结构简式是: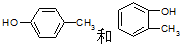 ,
,
答:该有机物的结构简式为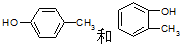 .
.
点评 本题考查有机物分子式的确定,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,本题易错点为(2),注意苯酚与溴发生取代反应的性质.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
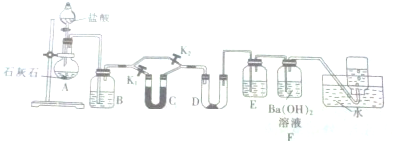
7.某学生做实验后,采用下列方法清洗所有仪器:
①用稀HNO3清洗做过银镜反应的试管
②用酒精清洗做过碘升华的烧杯
③用盐酸清洗长期盛放FeCl3溶液的试剂瓶
④用酒精清洗盛过苯酚的试管.
你认为他的操作( )
①用稀HNO3清洗做过银镜反应的试管
②用酒精清洗做过碘升华的烧杯
③用盐酸清洗长期盛放FeCl3溶液的试剂瓶
④用酒精清洗盛过苯酚的试管.
你认为他的操作( )
| A. | ②不对 | B. | ③不对 | C. | ①不对 | D. | 全部正确 |
1.下列各物质中,互为同系物的是( )
| A. | 丁烷和2,2-二甲基丙烷 | B. | 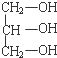 和 和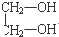 | ||
| C. | CH2=CH-CH=CH2和CH3-CH2-C≡CH | D. | 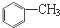 和 和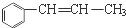 |
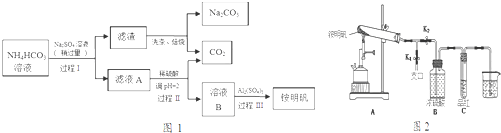
11. 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
(1)甲同学运用沉淀法测定样品中NaOH的含量.甲同学选用的药品除样品外,还应有氯化钡溶液,实验中应测定的数据有样品质量和沉淀的质量.
(2)乙同学运用滴定法测定样品中NaOH的含量.
①用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液.用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂.用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色变化.滴定终点的现象是由黄色变成橙色,且半分钟不褪色.
②下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D(填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
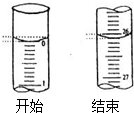
③若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0mL,终点读数26.10mL;
(3)某学生根据三次实验分别记录有关数据如下:
请选用其中合理的数据列式计算出该样品中NaOH的质量百分含量.(写出计算过程)
 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:(1)甲同学运用沉淀法测定样品中NaOH的含量.甲同学选用的药品除样品外,还应有氯化钡溶液,实验中应测定的数据有样品质量和沉淀的质量.
(2)乙同学运用滴定法测定样品中NaOH的含量.
①用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液.用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂.用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色变化.滴定终点的现象是由黄色变成橙色,且半分钟不褪色.
②下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D(填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
③若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0mL,终点读数26.10mL;
(3)某学生根据三次实验分别记录有关数据如下:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 20.00 | 0.00 | 26.01 |
| 第二次 | 20.00 | 1.56 | 30.30 |
| 第三次 | 20.00 | 0.22 | 26.21 |
18.乙醇分子中不同的化学键如图所示,下列不同反应中键的断裂不正确的是( )
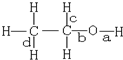

| A. | 和乙酸发生酯化反应键a断裂 | |
| B. | 和氢溴酸反应键a断裂 | |
| C. | 在铜催化和加热条件下和氧气反应键a、c断裂 | |
| D. | 和浓硫酸共热至170℃时键b和d断裂 |
15.能实现下列物质间直接转化的元素是( )
单质$\stackrel{+O2}{→}$氧化物$\stackrel{+H2O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐.
单质$\stackrel{+O2}{→}$氧化物$\stackrel{+H2O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐.
| A. | 铜 | B. | 铝 | C. | 铁 | D. | 钠 |
16.已知A、B、C、D、E、F六种元素的原子序数依次递增,前四种元素为短周期元素.A位于元素周期表s区,基态原子中电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每种能量不同的原子轨道中的电子数相同;C基态原子核外成对电子数为未成对电子数的3倍;D与C同主族;E、F位于同一周期和同一族,且E比F的核电荷数小2.
(1)E3+的核外有5个未成对电子,A2C2的电子式为 .
.
(2)F(BC)n的中心原子价电子数与配体提供电子总数之和为18,则n=4.
(3)B的一种氢化物分子中共有14个价电子,该分子中存在的共价键类型有ABFG.(填代号)
A.非极性键 B.极性键 C. s-sσ键 D.s-pσ键
E.p-pπ键 F.s-sp3σ键 G.sp3-sp3σ键H.sp3-sp3 π键
(4)A2D和A2C2的主要物理性质比较如下:
A2D和A2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因H2O2分子之间有氢键,而H2S分子间不存在氢键,所以H2O2的熔沸点比H2S高,H2O2与水分子之间能形成氢键,所以H2O2易溶于水,而H2S不能,所以H2O2在水中的溶解性比H2S好.
(1)E3+的核外有5个未成对电子,A2C2的电子式为
 .
.(2)F(BC)n的中心原子价电子数与配体提供电子总数之和为18,则n=4.
(3)B的一种氢化物分子中共有14个价电子,该分子中存在的共价键类型有ABFG.(填代号)
A.非极性键 B.极性键 C. s-sσ键 D.s-pσ键
E.p-pπ键 F.s-sp3σ键 G.sp3-sp3σ键H.sp3-sp3 π键
(4)A2D和A2C2的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| A2D | 187 | 202 | 2.6 |
| A2C2 | 272 | 423 | 以任意比互溶 |