题目内容
【题目】通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下:
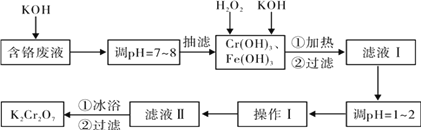
已知:①Cr(OH)3 + OH- = CrO2- + 2H2O; ②2CrO2- + 3H2O2 + 2OH- = 2CrO42- + 4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
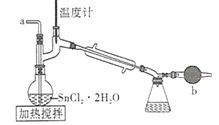
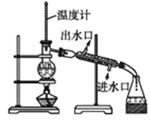
(1)如图是用KOH固体配制250mL 6 mol·L-1 KOH溶液的过程示意图。
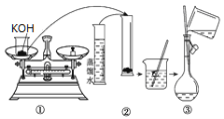
①请你观察图示判断,其中不正确的操作有(填序号)________;
②其中配制250 mL溶液的体积容器是(填名称)_________________;
③如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(2)滤液Ⅰ酸化前,进行加热的目的是_________________。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是_______。
(3)称取产品重铬酸钾试样2.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL 淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾氧化碘化钠的离子方程式_________。
②滴定终点的现象为_________。
③若实验中共用去Na2S2O3标准溶液30.00mL,所得产品中的重铬酸钾的纯度为_________(设整个过程中其它杂质不参与反应)。
④若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将_____________(填“偏高”、“偏低”或“不变”)。
【答案】②⑤ 250mL容量瓶 偏小 除去H2O2 除去晶体表面残留的杂质,减小K2Cr2O7的损耗 Cr2O72-+6I-+6H+=2Cr3++3I2+7H2O 加入最后一滴溶液,溶液由蓝色变成无色,且30s内不再变成蓝色 88.2% 偏高
【解析】
实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收,先加KOH把Cr3+、Fe3+转化沉淀分离出来,再向沉淀中加双氧水和KOH,发生Cr(OH)3+OH-=CrO2-+2H2O、2CrO2-+3H2O2+2OH-=2CrO42-+4H2O,把Cr(OH)3转化为CrO42-,酸性条件下CrO42-转化为Cr2O72-,通过蒸发浓缩,过滤得到K2Cr2O7,据此分析解答。
(1)①图中量筒不能溶解固体,应在烧杯中溶解后冷却转移到容量瓶中,定容时眼睛与凹液面的最低处相平,保持视线水平,图中定容时观察方法不合理,则图中②⑤错误,故答案为:②⑤;
②配制250mL溶液体积的容器为250mL容量瓶,故答案为:250mL容量瓶;
③图中仰视读数,导致溶液的体积V偏大,由c=![]() 可知,所配制的溶液浓度将偏小,故答案为:偏小;
可知,所配制的溶液浓度将偏小,故答案为:偏小;
(2)滤液Ⅰ酸化前,进行加热的目的是除去H2O2;冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是除去晶体表面残留的杂质,减小K2Cr2O7的损耗,故答案为:除去H2O2;除去晶体表面残留的杂质,减小K2Cr2O7的损耗;
(3)①重铬酸钾氧化碘化钠,Cr元素的化合价降低,I元素的化合价升高,反应的离子方程式为Cr2O72-+6I-+6H+=2Cr3++3I2+7H2O,故答案为:Cr2O72-+6I-+6H+=2Cr3++3I2+7H2O;
②滴定时发生的反应为I2+2S2O32-=2I-+S4O62-,用淀粉作指示剂,淀粉遇碘变蓝,当加入最后一滴溶液,溶液由蓝色变成无色,且30s内不再变成蓝色,表示到达滴定终点,故答案为:加入最后一滴溶液,溶液由蓝色变成无色,且30s内不再变成蓝色;
③由反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-可得反应的关系式为Cr2O72-~3I2~6S2O32-,则250mL溶液含重铬酸钾的物质的量为n=![]() ×
×![]() =0.006mol,则所得产品中重铬酸钾纯度为
=0.006mol,则所得产品中重铬酸钾纯度为![]() ×100%=88.2%,故答案为:88.2%;
×100%=88.2%,故答案为:88.2%;
④若滴定管在使用前未用Na2S2O3标准溶液润洗,导致消耗标准液的V偏大,测定K2Cr2O7的含量增大,则测得的重铬酸钾的纯度将偏高,故答案为:偏高。

【题目】如图是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是( )

氯化钠 (NaCl) | ≥98.0% (以NaCl计) |
碘酸钾 (KIO3) | (35±15)mg/kg (以I计) |
A.此食盐是纯净物
B.“加碘食盐”中的“碘”是指单质
C.1kg此食盐中含碘酸钾(35±15)mg
D.菜未烧熟不宜加入加碘的原因可能是碘酸钾受热不稳定
【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
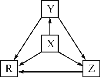
选项 | X | Y | Z | R |
A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
B | Na | Na2O | Na2O2 | NaOH |
C | H2S | S | SO2 | SO3 |
D | N2 | NH3 | NO | NO2 |
A.AB.BC.CD.D
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在50s时的速率v(PCl3)=0.0016molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11molL﹣1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%