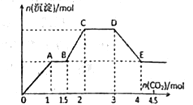
题目内容
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
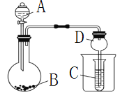
A. 若A为浓硫酸,B为K2SO3,C中盛品红溶液,则C中溶液褪色
B. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先变浑浊后澄清
C. 若A为醋酸,B为CaCO3,C中盛Na2SiO3溶液,则C中溶液中变浑浊
D. 若A为双氧水,B为MnO2,C中盛Na2S溶液,则C中溶液中变浑浊
【答案】B
【解析】
A、浓硫酸与K2SO3反应生成二氧化硫气体,二氧化硫具有漂白性,能够使品红褪色,故A正确;
B、浓氨水和生石灰CaO反应生成氨气,氨气溶于水生成氨水,氨水和AlCl3溶液反应生成氢氧化铝沉淀,且氨水是弱碱,不能溶解氢氧化铝,故B错误;
C、若A为醋酸,B为碳酸钙,二者反应会生成二氧化碳气体,二氧化碳气体与硅酸钠溶液反应生成硅酸沉淀,溶液变浑浊,故C正确;
D、双氧水在MnO2催化作用下,快速产生氧气,氧气具有氧化性,能够把-2价的硫氧化为硫单质,C中溶液中变浑浊,故D正确;
综上所述,本题选B。

【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E的化合物焰色反应是黄色,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)D的简单阴离子的结构示意图是___________。
(2)用电子式表示E2F的形成过程____________。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是_________>_________>_________。
(4)下列实验操作对应的实验现象中,不正确的是_________(填字母)。
选项 | 实验操作 | 实验现象 |
a | 将E单质投入到CuSO4溶液中 | 生成大量红色固体 |
b | 向AlCl3溶液中通入过量C的气态氢化物 | 先生成白色沉淀,然后沉淀溶解 |
c | 将G的单质通入到NaBr溶液中充分反应后,加入四氯化碳,振荡,静置 | 下层溶液变为橙色 |
d | 将B的最高价氧化物通入到Na2SiO3溶液中 | 生成白色沉淀 |
(5)写出A与B形成的10电子分子的化学式_________,该物质与G的单质在光照下反应,一段时间后,下列装置示意图中能正确反映实验现象的是_________(填字母)。

(6)在Fe和Cu的混合物中,加入一定量的C的最高价氧化物对应的水化物的稀溶液,充分反应后剩余金属m1 g,再向其中加入一定量的稀硫酸,充分反应后剩余金属m2 g。下列说法正确的是_________(填字母)。
a m1大于m2 b m1等于m2
c 剩余溶液中一定有Fe3+ d 剩余金属中一定有Cu