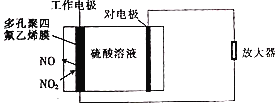
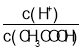题目内容
【题目】四氯化锡是一种无色有强烈的刺激性气味的液体,有腐蚀性,常用作媒染剂和有机合成上的氯化催化剂。工业上常用氯气与金属锡或 SnCl2 来制得。某化学兴趣小组把干燥氯气通入熔融 SnCl2 2H2O中制取无水SnCl4有如图所示的相关装置:
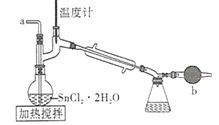
(1)盛装SnCl4的容器应贴上的安全警示标签是____________(填序号)。

(2)装置b的作用是______________________ 。
(3)为避免 SnCl4 水解,通Cl2 前应先除 SnCl2 的结晶水,其操作是_____________,在潮湿空气中 SnCl4 水解产生白色烟雾, 其化学方程式为 ________________ 。
(4)该学习小组最终制得的SnCl4 呈黄色,可能的原因是 ______________________,如果要除去黄色得到无色产品,你的做法是 ________________________。
(5)可以通过测定剩余SnCl4 的量来计算该次实验的产率, 方法是让残留的SnCl4 与足量硫酸铁铣反应,其中Fe3+被Sn2+还原为Fe2+。 然后在硫酸和磷酸混合条件下,以二苯胺磺酸钠作指示剂,用 K2Cr2O7 标准溶液滴定生成的Fe2+过程中的离子方程式为
a.Sn2++2Fe3+=2Fe2++Sn4+
b.Cr2O72-+____Fe2++(______)____=_____Cr3++______Fe3++(_____)_____
①完成并配平上述方程式b。
②已知二苯胺磺酸钠还原态为无色,氧化态为紫色,则滴定达到终点的现象是____
③若实验前称取 22.6g SnC12H2O晶体于烧瓶中,实验结束后,向烧瓶内残留物中通入足量N2,取烧瓶内残留物溶于水配成250mL 溶液,取25mL于锥形瓶中,用以上方法滴定,消耗0.0l 00mol/L K2Cr2O7标准溶20.00mL, 则 SnCl4的产率最大值为__________ 。
【答案】AC 除去尾气中的氯气,防止空气污染 防止外界水蒸气进入锥形瓶而使产物水解 从a口通入氯化氢气体,同时加热圆底烧瓶 SnCl4+4H2O=Sn(OH)4+4HCl(或SnCl4+2H2O=SnO2+4HCl) SnCl4溶有未反应的氯气 加入锡粒(或加热、向SnCl4中通入氮气等,合理给分) 1 6 14H+ 2 6 7H2O 滴入最后一滴标准液,溶液由无色变为浅紫色,且半分钟内不褪色 94%
【解析】
(1)根据题目中“四氯化锡是一种无色有强烈的刺激性液体,有腐蚀性”分析;
(2)根据仪器特点和作用分析;
(3)除去SnCl22H2O中结晶水,从抑制的SnCl2水解分析;SnCl4水解产生白色烟雾HCl和Sn(OH)4,据此书写;
(4)SnCl4呈黄色可能含有氯气,通入惰性气体赶走氯气或将氯气反应为产品均可;
(5)①反应条件是酸性环境,根据得失电子守恒和质量守恒可得;
②K2Cr2O7标准溶液滴定完生成的Fe2+时,开始氧化二苯胺磺酸钠,得其氧化态,据此可得;
③根据关系式:![]() ,则n(SnCl22H2O)=3n(K2Cr2O7),
,则n(SnCl22H2O)=3n(K2Cr2O7),
则22.6g样品中![]() ,据此计算。
,据此计算。
(1)已知:四氯化锡是一种无色有强烈的刺激性液体,有腐蚀性,则盛装SnCl4的容器应贴上的安全警示标签是腐蚀品,有刺激性,选AC;
故答案为:AC;
(2)装置b为干燥管,实验中氯气有毒不能直接排放,产物遇水易水解,装置应防止空气中的水蒸气进入,故干燥管的作用是:除去尾气中的氯气,防止空气污染,防止外界水蒸气进入锥形瓶而使产物水解;
故答案为:除去尾气中的氯气,防止空气污染,防止外界水蒸气进入锥形瓶而使产物水解;
(3)SnCl2水解:![]() ,为除去其结晶水,应在HCl的热气流中干燥,操作为:从a口通入氯化氢气体,同时加热圆底烧瓶;SnCl4水解产生白色烟雾HCl和Sn(OH)4,反应为:
,为除去其结晶水,应在HCl的热气流中干燥,操作为:从a口通入氯化氢气体,同时加热圆底烧瓶;SnCl4水解产生白色烟雾HCl和Sn(OH)4,反应为:![]() ;
;
故答案为:从a口通入氯化氢气体,同时加热圆底烧瓶; ![]() ;
;
(4)SnCl4呈黄色可能含有未反应的氯气,使其呈黄色;通入惰性气体赶走氯气或将氯气反应为产品均可,故加入锡粒(或加热、向SnCl4中通入氮气等)可除去黄色得到无色产品;
故答案为:SnCl4溶有未反应的氯气;加入锡粒(或加热、向SnCl4中通入氮气等);
(5)①在硫酸和磷酸混合条件下,K2Cr2O7标准溶液滴定生成的Fe2+。过程中的离子方程式为:![]() ;
;
故答案为:1;6;14H+;2;6;7H2O;
②K2Cr2O7标准溶液滴定完生成的Fe2+时,开始氧化二苯胺磺酸钠,得其氧化态,则当滴入最后一滴指示剂,溶液由无色变为浅紫色,且半分钟内不褪色,达到滴定终点;
故答案为:滴入最后一滴标准液,溶液由无色变为浅紫色,且半分钟内不褪色;
③根据关系式:![]() ,则n(SnCl22H2O)=3n(K2Cr2O7),
,则n(SnCl22H2O)=3n(K2Cr2O7),
则22.6g样品中![]() ,
,
则SnCl4的产率为![]() ;
;
故答案为:94%。
氧化还原方程式的配平根据得失电子守恒和质量守恒可得。

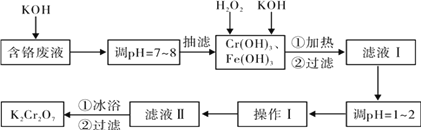
【题目】(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。写出FeCl3溶液腐蚀印刷电路铜板的离子方程式___。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤___。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
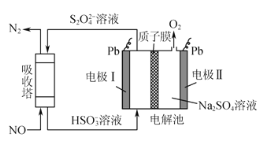
(2)间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。电极Ⅰ为___极,电极反应式为___,吸收塔中的反应为____,每处理1molNO,可同时得到___gO2。
(3)“重油-氧气-熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是(______)
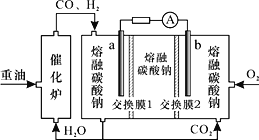
A.O2在b极得电子,最终被还原为CO32-
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,CO32-经“交换膜2”移向b极
D.H2参与的电极反应为H2-2e-+CO32-=H2O+CO2