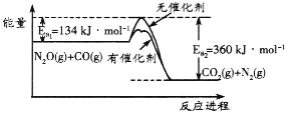
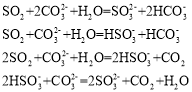题目内容
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在50s时的速率v(PCl3)=0.0016molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11molL﹣1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
【答案】C
【解析】
A. 反应在前50s内的平均速率![]() ,不是50s时,故A错误;
,不是50s时,故A错误;
B. 平衡时c(PCl3)=0.20mol÷2L=0.10 mol·L1,保持其他条件不变,升高温度,c(PCl3)增加,说明平衡正向移动,即正向是吸热反应,即反应的△H>0,故B错误;
C. 平衡时平衡常数为 ,相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,此时浓度商
,相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,此时浓度商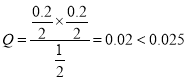 ,向正方向进行,则反应达到平衡前υ(正)>υ(逆),故C正确;
,向正方向进行,则反应达到平衡前υ(正)>υ(逆),故C正确;
D. 相同温度下,起始时向容器中充入2.0mol PCl3和2.0mol Cl2,等效为起始加入2.0mol PCl5,可以理解为先用两个相同大小的容器每个容器装1mol PCl5,达到平衡时,每个容器中有0.2mol PCl3,总共有0.4mol PCl3,则消耗1.6 mol PCl3,PCl3的转化率![]() ,将两个容器压缩到一个容器中,压强增大,平衡向逆反应方向移动,消耗PCl3物质的量大于1.6 mol,则转化率大于80%,故D错误。
,将两个容器压缩到一个容器中,压强增大,平衡向逆反应方向移动,消耗PCl3物质的量大于1.6 mol,则转化率大于80%,故D错误。
综上所述,答案为C。

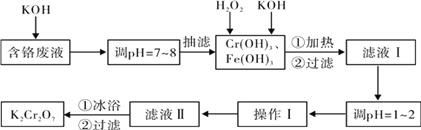
【题目】(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。写出FeCl3溶液腐蚀印刷电路铜板的离子方程式___。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤___。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
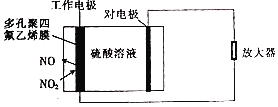
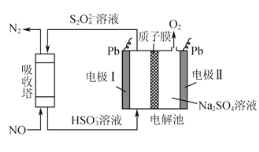
(2)间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。电极Ⅰ为___极,电极反应式为___,吸收塔中的反应为____,每处理1molNO,可同时得到___gO2。
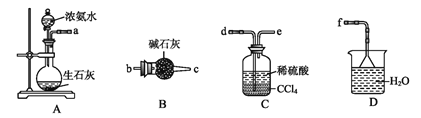
(3)“重油-氧气-熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是(______)
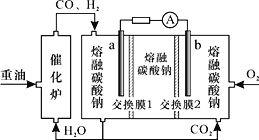
A.O2在b极得电子,最终被还原为CO32-
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,CO32-经“交换膜2”移向b极
D.H2参与的电极反应为H2-2e-+CO32-=H2O+CO2