题目内容
3.下列转化过程中,物质颜色变化对应点正确的是( )| A. | 金属钠在空气中燃烧:银白色→白色 | |
| B. | 纯铁丝在纯氧中燃烧:黑色→红色 | |
| C. | 加热溶有SO2的酚酞溶液:无色→红色 | |
| D. | 常温下NO接触空气:无色→红棕色 |
分析 A.钠燃烧生成淡黄色过氧化钠;
B.铁丝为银白色,燃烧生成黑色的四氧化三铁;
C.酚酞在酸性、中性溶液均为无色;
D.一氧化氮氧化生成二氧化氮.
解答 解:A.钠燃烧生成淡黄色过氧化钠,金属钠在空气中燃烧:银白色→淡黄色,故A错误;
B.纯铁丝在纯氧中燃烧:银白色→黑色,故B错误;
C.加热溶有SO2的酚酞溶液,溶液由酸性变为中性,颜色始终是无色,故C错误;
D.常温下NO接触空气氧化生成二氧化氮,二氧化氮为红棕色:无色→红棕色,故D正确;
故选:D.
点评 本题考查了元素化合物的性质,熟悉钠的性质是解题关键,题目难度不大.

练习册系列答案
 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
13.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 | |
| B. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):③>②>① | |
| C. | 常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后 |
14. 乙醇分子中各化学键如图所示.下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )
乙醇分子中各化学键如图所示.下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )
 乙醇分子中各化学键如图所示.下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )
乙醇分子中各化学键如图所示.下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )| A. | 与金属钠反应时,键①断裂 | |
| B. | 在加热和Cu催化下与O2反应时,键①、③断裂 | |
| C. | 与浓硫酸共热发生消去反应时,键②③断裂 | |
| D. | 与乙酸、浓硫酸共热发生酯化反应时,键①断裂 |
11.你认为下列说法正确的是( )
| A. | 含有N、O、F的分子和含有氢原子的分子间一定存在氢键 | |
| B. | 对于组成和结构相似的分子,其沸点随着相对分子质量的增大一定增大 | |
| C. | 甲醇极易溶于水而CH4难溶于水的原因只是甲醇是极性分子,CH4是非极性分子 | |
| D. | 过氧化氢气化时肯定只破坏分子间作用力和氢键 |
18.下列有关金属的工业制法中,正确的是( )
| A. | 制铁:以铁矿石为原料,CO还原得铁 | |
| B. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| C. | 制镁:用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁 | |
| D. | 制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝 |
12.卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子.若以它为原料按如图所示工艺流程进行生产,可制得轻质氧化镁.

已知1:生成氢氧化物沉淀的pH
已知2:几种难容电解质的溶解度(20℃)
(已知:Fe+氢氧化物呈絮状,不易从溶液中除去)
请回答:
(1)步骤Ⅱ中加入的试剂X为漂液(含25.2%NaClO).
①用玻璃棒蘸取漂液滴在pH试纸上,pH试纸先变蓝,后褪色.说明漂液就有的性质是碱性、强氧化性.
②用化学用语表示NaClO溶液使pH试纸变蓝的原因ClO-+H2O?HClO+OH-.
③步骤Ⅱ中漂液的主要作用是将Fe2+氧化为Fe3+.
④若用H2O2代替漂液,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)步骤Ⅲ中加入的试剂Y为NaOH,应将溶液的pH调节为9.8,目的是使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀以便通过过滤而除去.
(3)步骤Ⅳ中加入的试剂Z为Na2CO3,发生反应的离子方程式为Mg2++CO32-=MgCO3↓.
(4)结合化学用语,应用化学平衡移动原理解释步骤Ⅴ中反应发生的原因沉淀物MgCO3存在溶解平衡MgCO3(s)?Mg2+(aq)+CO32-(aq),CO32-发生水解CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,在煮沸情况下促进CO32-水解,Mg2+与OH-结合生成更难溶的Mg(OH)2沉淀,促进CO32-彻底水解为H2CO3,分解为CO2和H2O,最后MgCO3转化为Mg(OH)2.

已知1:生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 溶解度/g |
| Fe(OH)2 | 5.2×10-5 |
| Fe(OH)3 | 3×10-9 |
| MgCO3 | 3.9×10-2 |
| Mg(OH)2 | 9×10-4 |
请回答:
(1)步骤Ⅱ中加入的试剂X为漂液(含25.2%NaClO).
①用玻璃棒蘸取漂液滴在pH试纸上,pH试纸先变蓝,后褪色.说明漂液就有的性质是碱性、强氧化性.
②用化学用语表示NaClO溶液使pH试纸变蓝的原因ClO-+H2O?HClO+OH-.
③步骤Ⅱ中漂液的主要作用是将Fe2+氧化为Fe3+.
④若用H2O2代替漂液,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)步骤Ⅲ中加入的试剂Y为NaOH,应将溶液的pH调节为9.8,目的是使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀以便通过过滤而除去.
(3)步骤Ⅳ中加入的试剂Z为Na2CO3,发生反应的离子方程式为Mg2++CO32-=MgCO3↓.
(4)结合化学用语,应用化学平衡移动原理解释步骤Ⅴ中反应发生的原因沉淀物MgCO3存在溶解平衡MgCO3(s)?Mg2+(aq)+CO32-(aq),CO32-发生水解CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,在煮沸情况下促进CO32-水解,Mg2+与OH-结合生成更难溶的Mg(OH)2沉淀,促进CO32-彻底水解为H2CO3,分解为CO2和H2O,最后MgCO3转化为Mg(OH)2.
2.在某一化学反应中,反应物A的浓度在2s内由1.0mol/L变成0.2mol/L,则在这2s内它的平均反应速率为( )
| A. | 0.08mol/(L•s) | B. | 0.8mol/(L•s) | C. | 0.4mol/(L•s) | D. | 0.04mol/L |
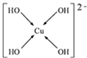 ;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-.
;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-.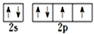 .
.