题目内容
14. 乙醇分子中各化学键如图所示.下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )
乙醇分子中各化学键如图所示.下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )| A. | 与金属钠反应时,键①断裂 | |
| B. | 在加热和Cu催化下与O2反应时,键①、③断裂 | |
| C. | 与浓硫酸共热发生消去反应时,键②③断裂 | |
| D. | 与乙酸、浓硫酸共热发生酯化反应时,键①断裂 |
分析 A、乙醇与金属钠反应生成乙醇钠,脱去羟基上的氢原子;
B、乙醇的催化氧化,脱去羟基上的氢原子和与羟基相连碳原子上的氢原子;
D、乙醇与乙酸发生酯化反应,酸脱羟基,醇脱氢;
C、乙醇与浓硫酸共热至170℃发生消去反应.
解答 解:A、乙醇与金属钠反应生成乙醇钠,脱去羟基上的氢原子,即键①断裂,故A正确;
B、乙醇在Cu催化下与O2反应生成乙醛,脱去羟基上的氢原子和与羟基相连碳原子上的氢原子,即键①、③断裂,故B正确;
C、乙醇与浓硫酸共热至170℃发生消去反应,脱去羟基和相邻碳原子上的氢,即键②、⑤断裂,故C错误;
D、乙醇与乙酸发生酯化反应,酸脱羟基,醇脱氢,即键①断裂,故D正确;
故选:C.
点评 乙醇的性质是高考热点题型,本题重点考查了乙醇发生化学反应式键的断裂情况.

练习册系列答案
相关题目
4.部分弱酸的电离平衡常数如下表:
下列选项错误的是( )
| 弱酸 | HA | HB | H2C |
| 电离平衡常数 (25℃) | K1=1.77×10-4 | K1=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | B-+HA→HB+A- | |
| B. | 2Bˉ+H2C→2HB+C2- | |
| C. | 中和等体积、等pH的HA和HB消耗NaOH的量前者小于后者 | |
| D. | 等体积、等浓度的NaA和NaB溶液中所含离子总数前者大于后者 |
5.能正确表示下列反应的离子方程式是( )
| A. | 碳酸氢钙溶液和氢氧化钠溶液混合 HCO3-+OH-═CO32-+H2O | |
| B. | 醋酸钠溶液和盐酸混合 CH3COONa+H+═CH3COOH+Na+ | |
| C. | 少量金属钠放入冷水中 Na+2H2O═Na++2OH-+H2↑ | |
| D. | 硫酸铜溶液和氢氧化钡溶液混合 Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ |
2.将等量的小苏打用下列两种方法制取CO2:甲法--加热,乙法--跟足量的酸反应.两种方法得到的CO2气体的量的关系为( )
| A. | 甲法多 | B. | 乙法多 | C. | 一样多 | D. | 无法比较 |
9.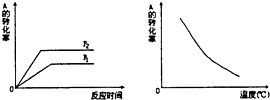 如图所示,可逆反应:mA(g)+nB(g)?xC(g),在不同温度、压强下反应物A的转化率的变化情况.下列对于反应的热效应和反应方程式中A、B、C的系数的判断中,正确的是( )
如图所示,可逆反应:mA(g)+nB(g)?xC(g),在不同温度、压强下反应物A的转化率的变化情况.下列对于反应的热效应和反应方程式中A、B、C的系数的判断中,正确的是( )
 如图所示,可逆反应:mA(g)+nB(g)?xC(g),在不同温度、压强下反应物A的转化率的变化情况.下列对于反应的热效应和反应方程式中A、B、C的系数的判断中,正确的是( )
如图所示,可逆反应:mA(g)+nB(g)?xC(g),在不同温度、压强下反应物A的转化率的变化情况.下列对于反应的热效应和反应方程式中A、B、C的系数的判断中,正确的是( )| A. | 放热,m+n>x | B. | 放热,m+n<x | C. | 吸热,m+n<x | D. | 吸热,m+n>x |
6.下列叙述都涉及化学相关知识,其中正确的是( )
| A. | 将置于海水中的钢铁设备作为阴极,接上直流电源和辅助阳极,使其受到保护的方法叫牺牲阳极的阴极保护法 | |
| B. | 200mlmol/LFe2(SO4)3溶液,Fe3+和SO42-,离子总数为NA | |
| C. | 10g 46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| D. | 可用电解氯化镁溶液的方法制取金属镁 |
3.下列转化过程中,物质颜色变化对应点正确的是( )
| A. | 金属钠在空气中燃烧:银白色→白色 | |
| B. | 纯铁丝在纯氧中燃烧:黑色→红色 | |
| C. | 加热溶有SO2的酚酞溶液:无色→红色 | |
| D. | 常温下NO接触空气:无色→红棕色 |
4.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 加入Mg能放出H2的溶液:Na+、Al3+、Cl-、SO42- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010的溶液:Fe2+、K+、NO3-、SO42- | |
| C. | 新制饱和氯水中:Na+、Al3+、SO32-、SO42- | |
| D. | 使甲基橙呈红色的溶液:NH4+、Na+、AlO2-、HCO3- |
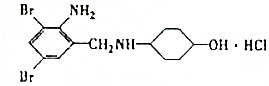
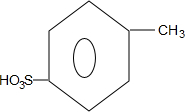 、
、 ;
;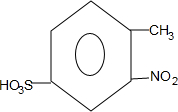 +H2O→
+H2O→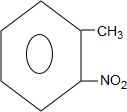 +H2SO4;
+H2SO4;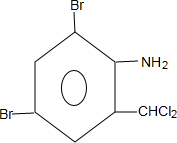 +2NaOH→
+2NaOH→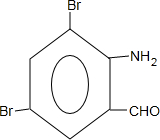 +2NaCl+H2O,写出H发生银镜反应的离子方程式
+2NaCl+H2O,写出H发生银镜反应的离子方程式 +NH4++2Ag↓+3NH3+H2O.
+NH4++2Ag↓+3NH3+H2O.