题目内容
11.你认为下列说法正确的是( )| A. | 含有N、O、F的分子和含有氢原子的分子间一定存在氢键 | |
| B. | 对于组成和结构相似的分子,其沸点随着相对分子质量的增大一定增大 | |
| C. | 甲醇极易溶于水而CH4难溶于水的原因只是甲醇是极性分子,CH4是非极性分子 | |
| D. | 过氧化氢气化时肯定只破坏分子间作用力和氢键 |
分析 A、含有N、O、F的分子和含有氢原子的分子间不一定存在氢键,如含氮的氮气与含氢的氢气分子间不存在氢键;
B、水与硫化氢是组成和结构相似的分子,但水分子间存在氢键,沸点异常的高;
C、甲醇极易溶于水主要因素是两个分子间形成了氢键;
D、气化是物理变化,过氧化氢是分子晶体,分子与分子之间存在氢键.
解答 解:A、含有N、O、F的分子和含有氢原子的分子间不一定存在氢键,如含氮的氮气与含氢的氢气分子间不存在氢键,所以并不是所以有含有N、O、F的分子和含有氢原子的分子间都存在氢键,故A错误;
B、水与硫化氢是组成和结构相似的分子,但水分子间存在氢键,沸点异常的高,所以相对分子质量大沸点不一定高,故C错误;
C、甲醇极易溶于水主要因素是两个分子间形成了氢键,故C错误;
D、气化是物理变化,过氧化氢是分子晶体,分子与分子之间存在氢键,所以过氧化氢气化时肯定只破坏分子间作用力和氢键,故D正确;
故选D.
点评 本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,注意氢键和化学键的区别,题目难度不大.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
1.某无色溶液与NaHCO3 作用能产生气体,此溶液中可能大量共存的离子组是( )
| A. | Na+、Ba2+、NO3-、SO42- | B. | Cl-、K+、H+、SO42- | ||
| C. | Na+、Cl-、K+、Ag+ | D. | Fe2+、SO42-、OH-、Na+ |
2.将等量的小苏打用下列两种方法制取CO2:甲法--加热,乙法--跟足量的酸反应.两种方法得到的CO2气体的量的关系为( )
| A. | 甲法多 | B. | 乙法多 | C. | 一样多 | D. | 无法比较 |
6.下列叙述都涉及化学相关知识,其中正确的是( )
| A. | 将置于海水中的钢铁设备作为阴极,接上直流电源和辅助阳极,使其受到保护的方法叫牺牲阳极的阴极保护法 | |
| B. | 200mlmol/LFe2(SO4)3溶液,Fe3+和SO42-,离子总数为NA | |
| C. | 10g 46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| D. | 可用电解氯化镁溶液的方法制取金属镁 |
16.能将已烯、已烷、乙醇、乙酸、乙醛、苯酚、硝酸银溶液7种物质鉴别开来的试剂组是( )
| A. | 氯化铁溶液、烧碱溶液、金属钠 | B. | 烧碱溶液、紫色石蕊试液 | ||
| C. | 新制Cu(OH)2悬浊液、紫色石蕊试液 | D. | 新制Cu(OH)2悬浊液、溴水 |
3.下列转化过程中,物质颜色变化对应点正确的是( )
| A. | 金属钠在空气中燃烧:银白色→白色 | |
| B. | 纯铁丝在纯氧中燃烧:黑色→红色 | |
| C. | 加热溶有SO2的酚酞溶液:无色→红色 | |
| D. | 常温下NO接触空气:无色→红棕色 |
20.下列措施不能加快Zn与1mol/LH2SO4反应产生H2的速率的是( )
| A. | 升高温度 | B. | 用Zn粉代替Zn粒 | ||
| C. | 改用0.1mol/LH2SO4与Zn反应 | D. | 滴加少量的CuSO4溶液 |
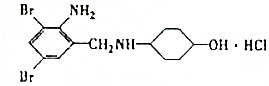
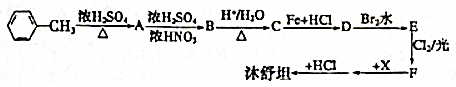
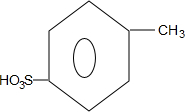 、
、 ;
;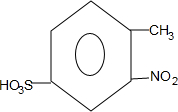 +H2O→
+H2O→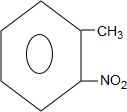 +H2SO4;
+H2SO4;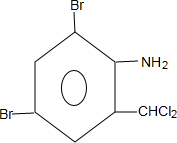 +2NaOH→
+2NaOH→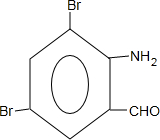 +2NaCl+H2O,写出H发生银镜反应的离子方程式
+2NaCl+H2O,写出H发生银镜反应的离子方程式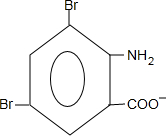 +NH4++2Ag↓+3NH3+H2O.
+NH4++2Ag↓+3NH3+H2O.