题目内容
13.下列溶液中有关微粒的物质的量浓度关系正确的是( )| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 | |
| B. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):③>②>① | |
| C. | 常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后 |
分析 A、亚铁离子也发生水解,结合物料守恒分析判断;
B、如果不考虑其他离子的影响,每摩尔物质都含有2 molNH4+,但溶液中CO32-的水解促进NH4+的水解,Fe2+的水解抑制NH4+的水解,以此解答该题;
C、将醋酸钠,盐酸两溶液混合,二者之间反应生成氯化钠和醋酸,溶液呈中性,则醋酸钠会剩余,根据电荷守恒和物料守恒知识来回答即可.
D、等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数,需要分析离子水解的过程中离子变化和特征分析.
解答 解:A、依据物料守恒分析,c(NH4+)+c(NH3•H2O)+c(Fe2+)+c(Fe(OH)2)=0.3 mol•L-1,故A错误;
B、溶液中CO32-的水解促进NH4+的水解,Fe2+的水解抑制NH4+的水解,则等浓度时,c(NH4+)大小顺序应为③>②>①,故B正确;
C、原来只有醋酸钠加入的盐酸没有醋酸根离子也没有钠离子,即n(Na+)=n(CH3COOH)+n(CH3COO-),因此:①C(Na+)=C(CH3COOH)+C(CH3COO-);因为显中性:c(H+)=c(OH-)从电荷守恒可知:C(Na+)+C(H+)=C(CH3COO-)+C(Cl-)+C(OH-),于是②C(Na+)=C(CH3COO-)+C(Cl-);
因此C(Na+)>C(Cl-),然后把①代入②式,消去C(Na+)得c(Cl-)=c(CH3COOH),因此得出C(Na+)>C(Cl-)=c(CH3COOH),故C错误;
D、等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数,ClO-+H2O?HClO+OH-,水解前后离子数不变,所以N后═N前,故D错误;
故选B.
点评 本题考查了溶液中电荷守恒应用,离子浓度大小比较,盐类水解的应用,完成该类题目,除了扎实掌握水溶液中离子平衡的基础知识外,还需掌握做题的技巧和方法,如电荷守恒式的灵活应用,该题综合性强,较为全面的考察了选修四中水溶液中的离子平衡,难度中等.

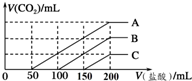 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )| A. | 通入CO2后,A烧杯中的溶质成分是Na2CO3 | |
| B. | B烧杯中通入的CO2体积为448 mL | |
| C. | 原NaOH溶液的浓度为0.2 mol/L | |
| D. | 通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=1:2 |
| 弱酸 | HA | HB | H2C |
| 电离平衡常数 (25℃) | K1=1.77×10-4 | K1=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | B-+HA→HB+A- | |
| B. | 2Bˉ+H2C→2HB+C2- | |
| C. | 中和等体积、等pH的HA和HB消耗NaOH的量前者小于后者 | |
| D. | 等体积、等浓度的NaA和NaB溶液中所含离子总数前者大于后者 |
| A. | Na+、Ba2+、NO3-、SO42- | B. | Cl-、K+、H+、SO42- | ||
| C. | Na+、Cl-、K+、Ag+ | D. | Fe2+、SO42-、OH-、Na+ |
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
①A元素在周期表中的位置第三周期第ⅥA族.
②用电子式表示A和B元素组成的化合物的形成过程
 .
.(2)元素D与元素A相比,D的非金属性较强,下列表述能证明这一事实的是ad(填选项符号).
a.D的氢化物比A的氢化物稳定
b.常温下D的单质和A的单质状态不同
c.一定条件下D和A的单质都能与钠反应
d.D的最价氧化物对应的水化物酸性强于A的最价氧化物对应的水化物的酸性
(3)X是由A、B、C、D四种元素中的某种元素形成的单质,能经如图所示的过程转化为W(其他条件略去).
X$\stackrel{{O}_{2}}{→}$Y$\stackrel{{O}_{2}}{→}$Z$\stackrel{{H}_{2}O}{→}$W
①若Z是红棕色气体,则 Z $\stackrel{H_{2}O}{→}$ W 的化学方程式为3NO2+H2O=2HNO3+NO,此反应中氧化剂与还原剂的物质的量之比是1:2.
②若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,再滴加适量H2O2 溶液,有白色沉淀生成,生成该白色沉淀的化学方程式为BaCl2+SO2+H2O2=BaSO4↓+2HCl.
| A. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 | |
| B. | 棉花、淀粉、植物油、蛋白质都是由高分子化合物组成的物质,都能水解,但水解产物不同 | |
| C. | 乙烷、乙烯、乙醇和乙酸互为同系物,葡萄糖与果糖互为同分异构体 | |
| D. | 乙烯、聚乙烯和苯都能使溴水褪色,褪色的原因相同 |
| A. | 碳酸氢钙溶液和氢氧化钠溶液混合 HCO3-+OH-═CO32-+H2O | |
| B. | 醋酸钠溶液和盐酸混合 CH3COONa+H+═CH3COOH+Na+ | |
| C. | 少量金属钠放入冷水中 Na+2H2O═Na++2OH-+H2↑ | |
| D. | 硫酸铜溶液和氢氧化钡溶液混合 Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ |
| A. | 甲法多 | B. | 乙法多 | C. | 一样多 | D. | 无法比较 |
| A. | 金属钠在空气中燃烧:银白色→白色 | |
| B. | 纯铁丝在纯氧中燃烧:黑色→红色 | |
| C. | 加热溶有SO2的酚酞溶液:无色→红色 | |
| D. | 常温下NO接触空气:无色→红棕色 |