题目内容
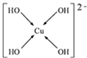
15.已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.元素M为第四周期元素,M原子核外最外层只有1个电子,其余各层电子均充满.请回答下列问题:(1)向MSO4溶液中加入过量NaOH溶液生成离子[M(OH)4]2-.若不考虑空间构型,则[M(OH)4]2-的结构可用示意图表示为
 ;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-.
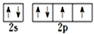
;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-.(2)Y元素原子外围电子排布图为
 .
.(3)X与Z可形成化合物XZ3,该化合物的空间构型为三角锥形.
(4)已知由元素X与镓元素组成的化合物A为第三代半导体.已知化合物A的晶胞结构与金刚石相似,其中X原子位于立方体内,镓原子位于立方体顶点和面心,请写出化合物A的化学式GaAs;化合物A可由(CH3)3Ga和XZ3在700℃下反应制得,反应的化学方程式为(CH3)3Ga+AsH3$\frac{\underline{\;700℃\;}}{\;}$GaAs+3CH4 .
(5)已知铝与镓元素位于同一主族,金属铝属立方晶系,其晶胞边长为405pm,密度是2.70g•cm-3,通过计算确定其晶胞的类型面心立方最密堆积(填简单立方堆积、体心立方堆积或面心立方最密堆积);晶胞中距离最近的铝原子可看作是接触的,计算铝的原子半径r(A1)=143.17pm.(计算结果保留小数点后两位;已知:4053≈6.64×107,$\sqrt{2}$=1.414)
分析 X元素原子的4p轨道上有3个未成对电子,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42-8-33=1,则Z为氢元素,氢原子可以形成负一价离子,符合题意.
(1)[Cu(OH)4]2-的中铜离子与氢氧根离子之间形成配位键,N3-和CO2是等电子体,则N3-中N原子之间形成2对共用电子对;
(2)Y为O元素,原子外围电子排布为2s22p4,结合泡利不相容原理与洪特规则画出外围电子排布图;
(3)X与Z可形成化合物AsH3,空间结构与氨气结构类似;
(4)As与镓元素组成的化合物A的晶胞结构与金刚石相似,其中As原子位于立方体内,镓原子位于立方体顶点和面心,晶胞中Ga原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、As原子数目=4,故该化合物化学式为GaAs,由(CH3)3Ga和AsH3在700℃下反应制得,由原子守恒可知有甲烷生成;
(5)根据密度、晶胞边长计算每个晶胞中含有的铝原子个数,根据铝原子个数判断晶胞类型,进而计算铝原子半径.
解答 解:X元素原子的4p轨道上有3个未成对电子,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42-8-33=1,则Z为氢元素,氢原子可以形成负一价离子,符合题意.
(1)[Cu(OH)4]2-的中铜离子与氢氧根离子之间形成配位键,其结构可用示意图 表示,N3-和CO2是等电子体,则N3-中N原子之间形成2对共用电子对,故其结构式为[N=N=N]-,
表示,N3-和CO2是等电子体,则N3-中N原子之间形成2对共用电子对,故其结构式为[N=N=N]-,
故答案为: ;[N=N=N]-;
;[N=N=N]-;
(2)Y为O元素,原子外围电子排布为2s22p4,外围电子排布图为 ,
,
故答案为: ;
;
(3)X与Z可形成化合物AsH3,与氨气结构类似,该化合物的空间构型为三角锥形,故答案为:三角锥形;
(4)金刚石的晶胞结构为 ,As与镓元素组成的化合物A的晶胞结构与金刚石相似,其中As原子位于立方体内,镓原子位于立方体顶点和面心,晶胞中Ga原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、As原子数目=4,故该化合物化学式为GaAs,由(CH3)3Ga和AsH3在700℃下反应制得,由原子守恒可知有甲烷生成,反应的化学方程式为:(CH3)3Ga+AsH3$\frac{\underline{\;700℃\;}}{\;}$GaAs+3CH4 ,
,As与镓元素组成的化合物A的晶胞结构与金刚石相似,其中As原子位于立方体内,镓原子位于立方体顶点和面心,晶胞中Ga原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、As原子数目=4,故该化合物化学式为GaAs,由(CH3)3Ga和AsH3在700℃下反应制得,由原子守恒可知有甲烷生成,反应的化学方程式为:(CH3)3Ga+AsH3$\frac{\underline{\;700℃\;}}{\;}$GaAs+3CH4 ,
故答案为:GaAs;(CH3)3Ga+AsH3$\frac{\underline{\;700℃\;}}{\;}$GaAs+3CH4 ;
(5)晶胞质量为2.70g•cm-3×(405×10-10cm)3,晶胞中Al原子数目为N(Al),则N(Al)×$\frac{27}{6.02×1{0}^{23}}$g=2.70g•cm-3×(405×10-10cm)3,解得N(Al)=4,该晶胞的每个顶点上和每个面上都含有一个Al原子,为面心立方晶胞;
面心立方晶胞中,每个面的对角线上三个原子紧挨着,所以对角线长度=$\sqrt{2}$×405pm,对角线为四个Al原子半径之和,所以每个铝原子半径=$\frac{1}{4}$×$\sqrt{2}$×405pm=143.17pm,
故答案为:面心立方最密堆积;143.17.
点评 本题是对物质结构的考查,涉及配合物、核外电子排布、分子构型、等电子体、晶胞有关计算等,晶胞的计算为难点、易错点,需要学生熟练掌握常见晶胞结构、具有一定的空间想象与数学计算能力.

| A. | 碳酸氢钙溶液和氢氧化钠溶液混合 HCO3-+OH-═CO32-+H2O | |
| B. | 醋酸钠溶液和盐酸混合 CH3COONa+H+═CH3COOH+Na+ | |
| C. | 少量金属钠放入冷水中 Na+2H2O═Na++2OH-+H2↑ | |
| D. | 硫酸铜溶液和氢氧化钡溶液混合 Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ |
| A. | 将置于海水中的钢铁设备作为阴极,接上直流电源和辅助阳极,使其受到保护的方法叫牺牲阳极的阴极保护法 | |
| B. | 200mlmol/LFe2(SO4)3溶液,Fe3+和SO42-,离子总数为NA | |
| C. | 10g 46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| D. | 可用电解氯化镁溶液的方法制取金属镁 |
| A. | 金属钠在空气中燃烧:银白色→白色 | |
| B. | 纯铁丝在纯氧中燃烧:黑色→红色 | |
| C. | 加热溶有SO2的酚酞溶液:无色→红色 | |
| D. | 常温下NO接触空气:无色→红棕色 |
| A. | 1 mol Cl2参加的任何反应,反应过程中转移电子数都是2NA | |
| B. | 标准状况下,22.4mL水中含有的分子数目约为1.24NA | |
| C. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| D. | 0.1 mol Na2O2中含有的离子数为0.4 NA |
| A. | 升高温度 | B. | 用Zn粉代替Zn粒 | ||
| C. | 改用0.1mol/LH2SO4与Zn反应 | D. | 滴加少量的CuSO4溶液 |
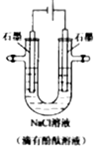 用石墨作电极,电解盛放在U形管中的饱和溶液和NaCl溶液(滴有酚酞溶液),如图,下列叙述正确的是( )
用石墨作电极,电解盛放在U形管中的饱和溶液和NaCl溶液(滴有酚酞溶液),如图,下列叙述正确的是( )| A. | 通电后,NaCl发生电离 | |
| B. | 通电一段时间后,阳极附近溶液先变红 | |
| C. | 当阳极生成0.1mol气体时,整个电路中转移了0.1mole- | |
| D. | 电解饱和食盐水的总反应式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑ |
| A. | 加入Mg能放出H2的溶液:Na+、Al3+、Cl-、SO42- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010的溶液:Fe2+、K+、NO3-、SO42- | |
| C. | 新制饱和氯水中:Na+、Al3+、SO32-、SO42- | |
| D. | 使甲基橙呈红色的溶液:NH4+、Na+、AlO2-、HCO3- |
| A. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| B. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| C. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| D. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |