题目内容
12.卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子.若以它为原料按如图所示工艺流程进行生产,可制得轻质氧化镁.
已知1:生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 溶解度/g |
| Fe(OH)2 | 5.2×10-5 |
| Fe(OH)3 | 3×10-9 |
| MgCO3 | 3.9×10-2 |
| Mg(OH)2 | 9×10-4 |
请回答:
(1)步骤Ⅱ中加入的试剂X为漂液(含25.2%NaClO).
①用玻璃棒蘸取漂液滴在pH试纸上,pH试纸先变蓝,后褪色.说明漂液就有的性质是碱性、强氧化性.
②用化学用语表示NaClO溶液使pH试纸变蓝的原因ClO-+H2O?HClO+OH-.
③步骤Ⅱ中漂液的主要作用是将Fe2+氧化为Fe3+.
④若用H2O2代替漂液,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)步骤Ⅲ中加入的试剂Y为NaOH,应将溶液的pH调节为9.8,目的是使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀以便通过过滤而除去.
(3)步骤Ⅳ中加入的试剂Z为Na2CO3,发生反应的离子方程式为Mg2++CO32-=MgCO3↓.
(4)结合化学用语,应用化学平衡移动原理解释步骤Ⅴ中反应发生的原因沉淀物MgCO3存在溶解平衡MgCO3(s)?Mg2+(aq)+CO32-(aq),CO32-发生水解CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,在煮沸情况下促进CO32-水解,Mg2+与OH-结合生成更难溶的Mg(OH)2沉淀,促进CO32-彻底水解为H2CO3,分解为CO2和H2O,最后MgCO3转化为Mg(OH)2.
分析 为除去Fe2+,先将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO.
(1)①漂液(含25.2%NaClO)中NaClO溶液中水解显碱性,PH变蓝色,蓝色褪去是水解生成的次氯酸具有漂白性;
②次氯酸根离子水解生成次氯酸和氢氧根离子;
③步骤Ⅱ中漂液是强氧化剂,氧化亚铁离子为铁离子;
④过氧化氢具有氧化性,酸性溶液中能氧化亚铁离子为铁离子;
(2)分析图表数据PH调节到9.8,保证镁离子不沉淀,其他金属离子全部沉淀;
(3)Z为Na2CO3,加入后沉淀镁离子;
(4)沉淀物MgCO3存在溶解平衡MgCO3(s)?Mg2+(aq)+CO32-(aq),CO32-发生水解CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,在煮沸情况下促进CO32-水解生成氢氧化镁沉淀.
解答 解:为除去Fe2+,先将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO,
(1)①漂液(含25.2%NaClO)中NaClO溶液中水解显碱性,PH变蓝色,蓝色褪去是水解生成的次氯酸具有漂白性,用玻璃棒蘸取漂液滴在pH试纸上,pH试纸先变蓝,后褪色.说明漂液就有的性质是碱性、漂白性,
故答案为:碱性、强氧化性(漂白性);
②NaClO溶液使pH试纸变蓝是次氯酸根离子水解生成次氯酸和氢氧根离子,溶液显碱性,反应的离子方程式为:ClO-+H2O?HClO+OH-,
故答案为:ClO-+H2O?HClO+OH-;
③步骤Ⅱ中漂液是强氧化剂,氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
④过氧化氢具有氧化性,酸性溶液中能氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)骤Ⅲ中加入的试剂Y为NaOH,应将溶液的pH调节为9.8,使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀以便通过过滤而除去,
故答案为:9.8;使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀以便通过过滤而除去;
(3)步骤Ⅳ中加入的试剂Z为Na2CO3,加入后沉淀镁离子,发生反应的离子方程式为:Mg2++CO32-=MgCO3↓,
故答案为:Mg2++CO32-=MgCO3↓;
(4)沉淀物MgCO3存在溶解平衡MgCO3(s)?Mg2+(aq)+CO32-(aq),CO32-发生水解CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,在煮沸情况下促进CO32-水解生成氢氧化镁沉淀,促进CO32-彻底水解为H2CO3,分解为CO2和H2O,最后MgCO3转化为Mg(OH)2,
故答案为:沉淀物MgCO3存在溶解平衡MgCO3(s)?Mg2+(aq)+CO32-(aq),CO32-发生水解CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,在煮沸情况下促进CO32-水解生成氢氧化镁沉淀,促进CO32-彻底水解为H2CO3,分解为CO2和H2O,最后MgCO3转化为Mg(OH)2.
点评 本题通过以卤块为原料制取轻质氧化镁的工艺流程,考查了物质制备实验方案的设计,题目难度中等,注意掌握化学基本实验操作方法,明确物质制备实验方案设计原则,本题中合理分析制取流程、得出氧化镁的制备原理为解题的关键,试题综合性较强、涉及知识点较多,充分考查了学生的分析、理解能力及化学实验能力.

| A. | 甲法多 | B. | 乙法多 | C. | 一样多 | D. | 无法比较 |
| A. | 金属钠在空气中燃烧:银白色→白色 | |
| B. | 纯铁丝在纯氧中燃烧:黑色→红色 | |
| C. | 加热溶有SO2的酚酞溶液:无色→红色 | |
| D. | 常温下NO接触空气:无色→红棕色 |
| A. | 升高温度 | B. | 用Zn粉代替Zn粒 | ||
| C. | 改用0.1mol/LH2SO4与Zn反应 | D. | 滴加少量的CuSO4溶液 |
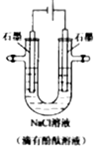 用石墨作电极,电解盛放在U形管中的饱和溶液和NaCl溶液(滴有酚酞溶液),如图,下列叙述正确的是( )
用石墨作电极,电解盛放在U形管中的饱和溶液和NaCl溶液(滴有酚酞溶液),如图,下列叙述正确的是( )| A. | 通电后,NaCl发生电离 | |
| B. | 通电一段时间后,阳极附近溶液先变红 | |
| C. | 当阳极生成0.1mol气体时,整个电路中转移了0.1mole- | |
| D. | 电解饱和食盐水的总反应式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑ |
| A. | 加入Mg能放出H2的溶液:Na+、Al3+、Cl-、SO42- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010的溶液:Fe2+、K+、NO3-、SO42- | |
| C. | 新制饱和氯水中:Na+、Al3+、SO32-、SO42- | |
| D. | 使甲基橙呈红色的溶液:NH4+、Na+、AlO2-、HCO3- |
