题目内容
14.铁元素是重要的金属元素,单质铁在工业和生活中应用广泛.铁还有很多重要的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H20(g)?Fe3O4(s)+4H2(g)△H(1)上述反应的平衡常数表达式K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:①3Fe(s)+2O2(g)═Fe3O4(s)△H1=-1118.4kJ•mol-1;
②2H2(g)+O2(g)═2H2O(g)△H2=-483.8kJ•mol-1;
③2H2(g)+O2(g)═2H2O(l)△H3=-571.8kJ•mol-1;
则△H=-150.8kJ/mol
(3)已知在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按如表所示加入物质,经过一段时间后达到平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法中正确的是B(填编号).
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)在三个2L恒容绝热(不与外界交换能量)的装置中,按如表加入起始物质,起始时与平衡后的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
(5)已知常温下Fe(OH)3的KSP=4.0×10-39,将某FeCl3溶液的pH调为3,此时溶液中c(Fe3+)=4.0×10-6mol•L-1(结果保留2位有效数字).
分析 (1)平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,固体纯液体不写入表达式;
(2)依据热化学方程式和盖斯定律计算所需热化学方程式,①-②×2得到3Fe(s)+4H20(g)?Fe3O4(s)+4H2(g);
(3)①根据初始的量,利用K的值结合三段式求算,设甲容器中达到平衡时转化的水的物质的量为xmol,
3Fe(s)+4H20(g)?Fe3O4(s)+4H2(g)
起始量(mol):1 1 1 1
转化量(mol):x x
平衡量(mol):1-x 1+x
平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变;
(4)恒容绝热根据反应时温度变化,判断平衡移动,分析氢气的百分含量,C条件下平衡不移动,A状况下,反应正向进行生成氢气,B状况下反应逆向进行生成Fe和水;
(5)根据FeCl3溶液的pH为3,即c(H+)=10-3mol/L,则c(OH-)=10-11mol/L,结合Fe(OH)3的Ksp计算c(Fe3+).
解答 解:(1)3Fe(s)+4H20(g)?Fe3O4(s)+4H2(g),平衡常数K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$,
故答案为:$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$;
(2)①3Fe(s)+2O2(g)═Fe3O4(s)△H1=-1118.4kJ•mol-1;
②2H2(g)+O2(g)═2H2O(g)△H2=-483.8kJ•mol-1;
③2H2(g)+O2(g)═2H2O(l)△H3=-571.8kJ•mol-1;
依据盖斯定律①-②×2得到3Fe(s)+4H20(g)?Fe3O4(s)+4H2(g)△H=-150.8KJ/mol,
故答案为:-150.8KJ/mol;
(3)①设甲容器中达到平衡时转化的水的物质的量为xmol,
3Fe(s)+4H20(g)?Fe3O4(s)+4H2(g)
起始量(mol):1 1 1 1
转化量(mol):x x
平衡量(mol):1-x 1+x
则K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$=$\frac{(1+x)^{4}}{(1-x)^{4}}$=16,所以x=$\frac{1}{3}$,则甲容器中H2O的平衡转化率为$\frac{\frac{1}{3}mol}{1mol}$×100%=33.3%,
故答案为:33.3%;
②A、该反应为气体体积不变的反应,所以容器内压强始终不变,不能用压强判断平衡状态,故A错误;
B、水蒸气的密度与氢气的密度不同,所以当容器内的密度不变时,即是平衡状态,故B正确;
C、设乙中水转化了xmol,则$\frac{(\frac{1+x}{2})^{4}}{(\frac{1.5+x}{2})^{4}}$=K=16,则x=0.667,所以乙中水的转化率为$\frac{0.667}{1.5}$×100%=44.4%,所以大于甲中转化率33.3%,故C错误;
D、增加固体的量平衡不移动,所以水的转化率不变,故D错误;
故答案为:B;
(4)由于反应前后气体体积相等,所以C条件下,平衡不移动,氢气的体积分数与平衡是相同;A状况下,反应正向进行生成氢气,反应放出热量使容器温度升高,抑制反应继续生成氢气,故氢气体积分数较低,B状况下反应逆向进行生成Fe和水,是吸热过程,使容器温度降低,抑制反应继续消耗氢气,所以氢气的体积分数较高,故H2的百分含量按由大到小的顺序排列:B>C>A;
故答案为:B>C>A;
(5)已知Fe(OH)3的Ksp=4.0×10-39,而某FeCl3溶液的pH为3,即c(H+)=10-3mol/L,则c(OH-)=10-11mol/L,所以c(Fe3+)=$\frac{Ksp}{{c}^{3}(O{H}^{-})}$=2$\frac{4.0×1{0}^{-39}}{(1{0}^{-11})^{3}}$=4.0×10-6mol/L;
故答案为:4.0×10-6.
点评 本题考查了化学平衡常数、盖斯定律、平衡状态的判断、Ksp的计算等,题目综合性较强,难度较大,侧重于对有关原理应用的考查.

| A. | 原电池是把电能转化为化学能的装置 | |
| B. | 原电池两极均发生氧化还原反应 | |
| C. | 原电池中的阳离子向正极移动 | |
| D. | 原电池中电子流出的一极是正极,发生氧化反应 |
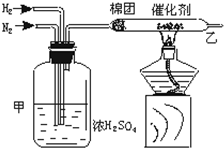 实验室中可用如图所示的装置合成NH3.
实验室中可用如图所示的装置合成NH3.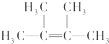 ;名称是2,3-二甲基-2-丁烯.
;名称是2,3-二甲基-2-丁烯.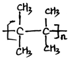 .
. 、(CH3CH2)2C=CH2.
、(CH3CH2)2C=CH2.



 )发生缩聚反应产物的结构简式为
)发生缩聚反应产物的结构简式为 ;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为
;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为 .
.
 ;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为
;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为 .
.