题目内容
6.著名主持人柴静自费拍摄的《穹顶之下》讲述了雾霾对人类的影响.我国已有100多座大中城市不同程度地出现了雾霾天气,覆盖了我国将近一半的国土.随着大气污染的日趋严重.国家拟定于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NO2)排放量也要大幅减少.
Ⅰ.工业上采用碘循环工艺吸收SO2,具体流程如下:
(1)用离子方程式表示反应器中发生的反应SO2+I2+2H2O=SO42-+2I-+4H+.
(2)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行.
Ⅱ.处理NO2的一种方法是利用甲烷催化还原NO2.
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ•mol-1
则△H2=-1160kJ•mol-1.
Ⅲ.为减少二氧化碳的排放.对二氧化碳进行如下处理.
(1)一定温度下,在2L容积固定的密闭容器中,通入2molCO2和3molH2,发生的反应为:CO2(g)+3H2(g)?CH3COH(g)+H2O(g)△H=-akJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示.
①能说明该反应已达到平衡状态的是AB.
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2molH2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算温度下此反应的平衡常数K=0.20.
(2)某甲醇燃料电池原理如图1所示.
①pb(a)电极的电极反应式为CH3OH-6e-+H2O=CO2+6H+.
②用上述甲醇燃料电池做电源.用图3装置电解跑题硫酸铜溶液若在图2中Pt电极上生成64g铜,则图2中Pt(b)电极上需要消耗标准状况下空气(O2的体积分数20%)的体积为56L.

分析 Ⅰ.(1)反应器中二氧化硫、碘发生氧化还原反应生成硫酸和HI;
(2)HI分解反应为可逆反应;
Ⅱ.依据热化学方程式和盖斯定律③×2-①计算目标热化学方程式得到焓变;
Ⅲ.(1)①化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
②根据图象数据结合平衡常数K的计算公式进行计算;
(2)①首先根据pb(a)电极上为甲醇失电子在负极发生氧化反应生成二氧化碳,据此书写电极反应式;
②整个电路中转移电子的数目相等,可以根据电子转移的数目相同来列出已知物质和未知物质之间关系式,然后通过关系来求解.
解答 解:Ⅰ.(1)反应器中二氧化硫、碘发生氧化还原反应生成硫酸和HI,离子反应为SO2+I2+2H2O=SO42-+2I-+4H+,故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
(2)HI分解反应为可逆反应,则使用膜反应器分离出H2的目的是及时分离出产物H2,有利于反应正向进行,故答案为:HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
Ⅱ.①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3=-867kJ•mol-1
依据盖斯定律计算,③×2-①得到CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1;
故答案为:-1160kJ•mol-1;
Ⅲ.(1)①A.CO2的体积分数在混合气体中保持不变,则能说明达到平衡状态,故A正确;
B.平均相对分子质量=$\frac{总质量}{总物质的量}$,总质量一定,总物质的量在变,故平均相对分子质量在变,故平均相对分子质量不再发生改变能说明达到平衡状态,故B正确;
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O,不能体现正逆反应,故不能说明达到平衡状态,故C错误;
D.H2O与CH3OH都是产物,并且按照1:1的比例生成,所以H2O与CH3OH的物质的量浓度之比一直为1:1,不能说明达到平衡状态,故D错误;
故选AB;
②由图象数据CO2(g)+3H2(g)?CH3OH(g)+H2O(g)得
开始浓度:1 1.5 0 0
转化浓度:0.25 0.75 0.25 0.25
平衡浓度:0.75 0.75 0.25 0.25
所以K=$\frac{0.25×0.25}{0.75×0.75{\;}^{3}}$=0.20,故答案为:0.20;
(2)①根据pb(a)电极上为甲醇失电子在负极发生氧化反应生成二氧化碳,则电极反应式为CH3OH-6e-+H2O=CO2+6H+,故答案为:CH3OH-6e-+H2O=CO2+6H+;
②电解硫酸铜溶液时,铜电极上铜失电子发生氧化反应,当铜片的质量变化64g,失去电子的物质的量=$\frac{64g}{64g/mol}$×2=2mol,
1mol氧气生成-2价氧元素得到4mol电子,则需要空气的体积=$\frac{\frac{2mol}{4}×22.4L/mol}{20%}$=56L,
故答案为:56.
点评 本题考查氧化还原反应、电化学以及化学平衡的有关知识,为高考常见题型和高频考点,注意把握原电池的工作原理,本题解答的关键是根据电子转移的数目相同计算,注意体会答题思路,题目难度中等.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 吸热反应一定需要加热才能发生 | |
| C. | 凡是放热反应的发生均无需加热 | |
| D. | 伴有能量变化的物质变化都是化学变化 |
(1)上述反应的平衡常数表达式K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:①3Fe(s)+2O2(g)═Fe3O4(s)△H1=-1118.4kJ•mol-1;
②2H2(g)+O2(g)═2H2O(g)△H2=-483.8kJ•mol-1;
③2H2(g)+O2(g)═2H2O(l)△H3=-571.8kJ•mol-1;
则△H=-150.8kJ/mol
(3)已知在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按如表所示加入物质,经过一段时间后达到平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法中正确的是B(填编号).
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)在三个2L恒容绝热(不与外界交换能量)的装置中,按如表加入起始物质,起始时与平衡后的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
(5)已知常温下Fe(OH)3的KSP=4.0×10-39,将某FeCl3溶液的pH调为3,此时溶液中c(Fe3+)=4.0×10-6mol•L-1(结果保留2位有效数字).
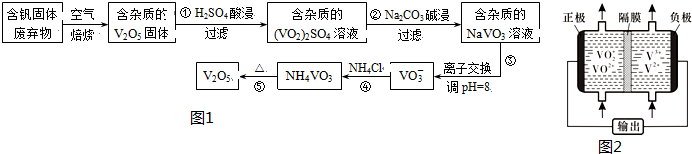
部分含钒化合物在水中的溶解性如表:
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$KJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO+H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.
| A. | FeO、FeS、CuO、CuS、稀硫酸 | |
| B. | 苯、四氯化碳、无水乙醇、己烯 溴水 | |
| C. | 甲酸、乙酸、乙醛、乙醇 新制氢氧化铜悬浊液 | |
| D. | 苯酚钠溶液、甲苯、乙酸乙酯、乙酸 饱和碳酸钠溶液 |
| A. | 酸雨是指pH<5.6雨 | |
| B. | 在正常情况下人体血液pH为7.35~7.45 | |
| C. | 有色水泥主要是因为水泥中含有CuCl2 | |
| D. | 红色玻璃主要是因为玻璃中含有少量Cu2O |