题目内容
11.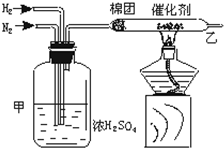 实验室中可用如图所示的装置合成NH3.
实验室中可用如图所示的装置合成NH3.试回答下列问题:
(1)请写出装置甲的三个作用:①干燥氮气和氢气、②使氮气和氢气混合均匀、③通过观察气泡控制气体比例和流速.
(2)从乙导出的气体是N2、H2、NH3,检验产物的简单化学方法是用红色的石蕊试纸放在导气管口,如果湿润的红色石蕊试纸变蓝,则有氨气.
分析 (1)装置甲作用:干燥氮气和氢气;使氮气和氢气混合均匀;通过观察气泡控制气体比例和流速;
(2)氮气和氢气合成氨反应为可逆反应,不能进行到底,氨气为碱性气体,与水反应生成一水合氨,一水合氨显碱性,能够使红色石蕊试纸变蓝.
解答 解:(1)装置甲的三个作用:干燥氮气和氢气;使氮气和氢气混合均匀;通过观察气泡控制气体比例和流速;
故答案为:干燥氮气和氢气;使氮气和氢气混合均匀;通过观察气泡控制气体比例和流速;
(2)氮气和氢气合成氨反应为可逆反应,不能进行到底,所以从乙装置出来的气体有未反应的N2、H2和生成的NH3,
氨气为碱性气体,与水反应生成一水合氨,一水合氨显碱性,能够使红色石蕊试纸变蓝,检验产物的简单化学方法:
用红色的石蕊试纸放在导气管口,如果湿润的红色石蕊试纸变蓝,则有氨气;
故答案为:N2、H2、NH3;用红色的石蕊试纸放在导气管口,如果湿润的红色石蕊试纸变蓝,则有氨气.
点评 本题考查了氨气的合成,熟悉合成氨反应的特点及装置的用途是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列关于△H-T△S说法中正确的是( )
| A. | △H<0、△S<0的反应在任何温度下都可以自发进行 | |
| B. | 蔗糖溶于水及气体扩散过程均是熵减过程 | |
| C. | △H-T△S只用于判断温度、压强一定的反应能否自发进行 | |
| D. | △H-T△S<0的反应,在该条件下一定剧烈反应 |
2.从某些植物树叶提取的挥发油中含有下列主要成分:
A.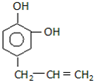 B.
B.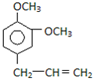 C.
C.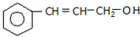
(1)2mol A与溴水充分反应,需消耗8 mol单质溴.
(2)写出B的分子式C11H14O2
(3)C与氢气完全加成后产物的结构简式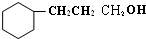 .
.
A.
 B.
B. C.
C.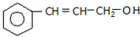
(1)2mol A与溴水充分反应,需消耗8 mol单质溴.
(2)写出B的分子式C11H14O2
(3)C与氢气完全加成后产物的结构简式
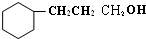 .
.
19.${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、H+、H2是( )
| A. | 氢的五种不同粒子 | B. | 五种氢元素 | ||
| C. | 氢的五种同素异形体 | D. | 氢元素的五种同位素 |
6.下列说法正确的是( )
| A. | HF、HCl、HBr、HI 的热稳定性依次减弱 | |
| B. | HF、HCl、HBr、HI 的熔沸点逐渐升高 | |
| C. | 第ⅠA族元素和第ⅦA元素形成的化合物都属于离子化合物 | |
| D. | 因为H2O分子间存在氢键,所以热稳定性:H2O>H2S |
3.下列说法正确的是( )
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 吸热反应一定需要加热才能发生 | |
| C. | 凡是放热反应的发生均无需加热 | |
| D. | 伴有能量变化的物质变化都是化学变化 |
14.铁元素是重要的金属元素,单质铁在工业和生活中应用广泛.铁还有很多重要的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H20(g)?Fe3O4(s)+4H2(g)△H
(1)上述反应的平衡常数表达式K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:①3Fe(s)+2O2(g)═Fe3O4(s)△H1=-1118.4kJ•mol-1;
②2H2(g)+O2(g)═2H2O(g)△H2=-483.8kJ•mol-1;
③2H2(g)+O2(g)═2H2O(l)△H3=-571.8kJ•mol-1;
则△H=-150.8kJ/mol
(3)已知在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按如表所示加入物质,经过一段时间后达到平衡.
①甲容器中H2O的平衡转化率为33.3%(结果保留一位小数);
②下列说法中正确的是B(填编号).
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)在三个2L恒容绝热(不与外界交换能量)的装置中,按如表加入起始物质,起始时与平衡后的各物质的量见表:
若向上述平衡后的装置中分别继续按A、B、C三种情况加入物质,见表:
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的百分含量按由大到小的顺序排列:B>C>A(用A、B、C表示).
(5)已知常温下Fe(OH)3的KSP=4.0×10-39,将某FeCl3溶液的pH调为3,此时溶液中c(Fe3+)=4.0×10-6mol•L-1(结果保留2位有效数字).
(1)上述反应的平衡常数表达式K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:①3Fe(s)+2O2(g)═Fe3O4(s)△H1=-1118.4kJ•mol-1;
②2H2(g)+O2(g)═2H2O(g)△H2=-483.8kJ•mol-1;
③2H2(g)+O2(g)═2H2O(l)△H3=-571.8kJ•mol-1;
则△H=-150.8kJ/mol
(3)已知在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按如表所示加入物质,经过一段时间后达到平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法中正确的是B(填编号).
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)在三个2L恒容绝热(不与外界交换能量)的装置中,按如表加入起始物质,起始时与平衡后的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
(5)已知常温下Fe(OH)3的KSP=4.0×10-39,将某FeCl3溶液的pH调为3,此时溶液中c(Fe3+)=4.0×10-6mol•L-1(结果保留2位有效数字).
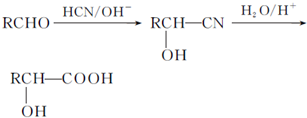

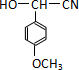 .
.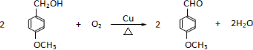 .
.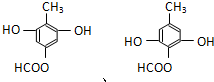 .
.