题目内容
11.多晶硅是太阳能光伏产业的重要原材料.(1)由石英砂可制取粗硅,反应式为SiO2(s)+2C(s)═Si(s)+2CO(g),粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g)?Si(s)+3HCl(g)不同温度及不同$\frac{n({H}_{2})}{n(SiHC{l}_{3})}$时,反应物X的平衡转化率关系如图所示.
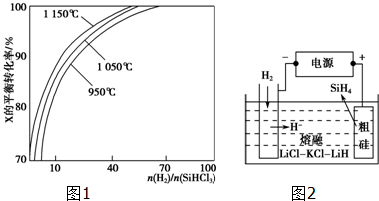
①X是SiHCl3(填“H2”或“SiHCl3”).
②上述反应的平衡常数K(1150℃)>K(950℃)(填“>”、“<”或“=”).
(2)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法.
①用粗硅作原料,熔融盐电解法制取硅烷原理如图所示,电解时阳极的电极反应式为Si+4H--4e-=SiH4↑.
②硅基太阳电池需用N、Si两种元素组成的化合物Y作钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到,已知Y中Si的质量分数为60%,Y的化学式为Si3N4.
分析 (1)①根据图象可知:横坐标表示氢气的量增多;
②温度越高,SiHCl3的转化率高,即反应进行的程度大;
(2)①电解池中的阳极上发生失电子的氧化反应,单质硅失电子后和H-结合生成SiH4;
②Si的质量分数为60%,氧的质量分数为40%,据此确定化学式.
解答 解:(1)①两种反应物,增加其中一种,另一种物质的转化率增大,自身的转化率反而减小,横坐标表示氢气的量增多,所以纵坐标表示的转化率提高应为SiHCl3,
故答案为:SiHCl3;
②当$\frac{n({H}_{2})}{n(SiHCl{\;}_{3})}$一定时,温度越高,SiHCl3的转化率高,即反应进行的程度大,所以高温时的化学平衡常数大,则该反应的平衡常数随温度升高而增大,即K(1150℃)>K(950℃);
故答案为:>;
(2)①此题类似于电解精炼铜的原理,用粗铜作为阳极,从图示知,H-移向阳极生成SiH4,电极反应式为Si+4H--4e-=SiH4↑,
故答案为:Si+4H--4e-=SiH4↑;
②n(Si):n(N)=$\frac{60%}{28}$:$\frac{40%}{14}$=3:4,化学式为Si3N4,故答案为:Si3N4.
点评 本题考查硅及其化合物的性质,读懂图象、理顺平衡常数与转化率间的关系、注意电化学电极反应式的书写是解题的关键,题目难度中等.

练习册系列答案
相关题目
1.已知锌与稀盐酸反应放热.某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气.所用稀盐酸浓度为1.00mol•L-1、2.00mol•L-1,锌有细颗粒与粗颗粒两种规格,用量为6.50g.实验温度为298K、308K,每次实验稀盐酸的用量为25.0mL.
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
(2)实验①记录如下:
①计算在30-40s范围内盐酸的平均反应速率v(HCl)=0.56mol/(L•s).(忽略溶液体积变化,不需要写出计算过程).
②反应速率最大的时间段(即0~10S、10~20S、20~30S、30~40S、40~50S…)为40~50S,可能原因是反应放热;
③反应速率最小的时间段为90~100s,可能原因是盐酸浓度降低.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率:
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);
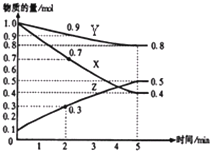
(4)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如右图所示.该反应的化学方程式为:3X+Y?2Z.
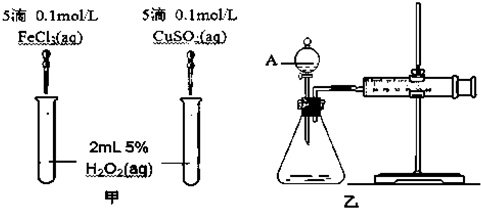
(5)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察生成气泡的快慢判断,
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是产生40ml气体所需要的时间.
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(S) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (ml) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
②反应速率最大的时间段(即0~10S、10~20S、20~30S、30~40S、40~50S…)为40~50S,可能原因是反应放热;
③反应速率最小的时间段为90~100s,可能原因是盐酸浓度降低.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率:
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);
(4)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如右图所示.该反应的化学方程式为:3X+Y?2Z.

(5)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察生成气泡的快慢判断,
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是产生40ml气体所需要的时间.

19.用铁片与稀硫酸反应时,下列措施不能使反应速率加快的是( )
| A. | 加热 | B. | 滴加少量的CuSO4溶液 | ||
| C. | 不用稀硫酸,改用98%浓硫酸 | D. | 不用铁片,改用铁粉 |
6.下列关于晶体的说法正确的组合是( )
①离子晶体中都存在离子键,肯定没有共价键
②分子晶体中都存在共价键,肯定没有离子键
③金刚石、SiC、NaF、NaCl、H2O、H2Se晶体的熔点依次降低
④在晶体中只要有阴离子就一定有阳离子
⑤金属晶体的熔点普遍都很高
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦分子晶体中分子间作用力越大,分子越稳定.
①离子晶体中都存在离子键,肯定没有共价键
②分子晶体中都存在共价键,肯定没有离子键
③金刚石、SiC、NaF、NaCl、H2O、H2Se晶体的熔点依次降低
④在晶体中只要有阴离子就一定有阳离子
⑤金属晶体的熔点普遍都很高
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦分子晶体中分子间作用力越大,分子越稳定.
| A. | ①②③⑥ | B. | ②④⑥ | C. | ③⑤⑥⑦ | D. | ③④ |
3.将充满20mL NO试管倒置于盛有蒸馏水的烧杯中,然后向试管中通入纯O2,当试管内液面稳定在试管容积的一半时,则通入O2可能为( )
| A. | 25.0mL | B. | 35.0mL | C. | 17.5mL | D. | 7.5mL |
20.某些不合格的建筑装饰材料,会缓慢的释放出浓度过高,影响人体健康的气体,这些气体最常见的是( )
| A. | 二氧化氮 | B. | 二氧化硫 | ||
| C. | 一氧化氮 | D. | 甲醛和苯、甲苯等有机物气体 |
1.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.4NA | |
| B. | 18gD2O中含有的质子数目为10NA | |
| C. | 1molCl2发生反应时,转移的电子数一定是2NA | |
| D. | 常温常压下,16gO3所含的原子数为NA |

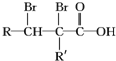 ,A的化学式是C14H18O,A可以发生的反应是aef(填写序号字母).
,A的化学式是C14H18O,A可以发生的反应是aef(填写序号字母).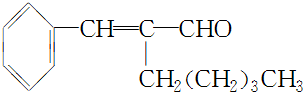 .
. +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH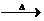
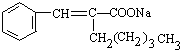 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.