题目内容
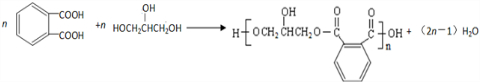
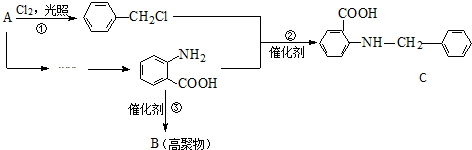
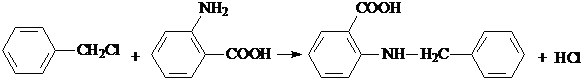
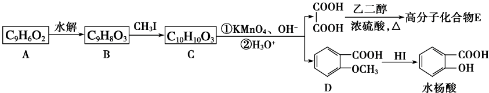
20.已知: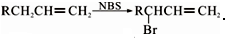 .醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路:
.醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路: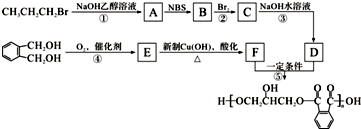
(1)B中含碳官能团的结构式为
 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷.(2)反应①的有机反应类型是消去反应.
(3)下列说法正确的是ab(填序号).
a.F能与NaHCO3反应产生CO2
b.1molE与足量的银氨溶液反应能生成4molAg
c.检验CH3CH2CH2Br中的溴原子时,所加试剂的 顺序依次是过量氢氧化钠溶液、硝酸银溶液
(4)写出反应⑤的化学方程式
 .
.(5)
 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种.a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀
(6)以丙烯为原料经如下步骤可以合成粘合剂-聚丙烯醇:
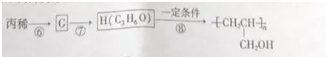
反应⑥的有机反应类型是取代反应,反应⑦所选用的试剂是氢氧化钠水溶液,聚丙烯醇单体的结构简式是
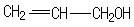 .
.
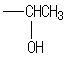
分析 1-溴丙烷发生消去反应生成A为CH3CH=CH2,A与NBS发生取代反应生成B为BrCH2CH=CH2,B与溴发生加成反应生成C为BrCH2CHBrCH2Br,C发生水解反应生成D为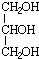 .
. 发生催化氧化生成E为
发生催化氧化生成E为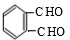 ,E进一步发生氧化反应生成F为
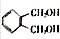
,E进一步发生氧化反应生成F为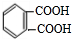 ,F与丙三醇发生缩聚反应生成高聚物.
,F与丙三醇发生缩聚反应生成高聚物.
(5)满足题意的同分异构体中,苯环上应该含有-OH和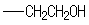
(6)根据信息反应,⑥是丙烯与NBS发生取代反应引入溴原子生成G为BrCH2CH=CH2,反应⑦是溴原子在氢氧化钠水溶液、加热条件下被羟基取代,则H为丙烯醇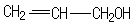
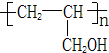 .
.
解答 解:1-溴丙烷发生消去反应生成A为CH3CH=CH2,A与NBS发生取代反应生成B为BrCH2CH=CH2,B与溴发生加成反应生成C为BrCH2CHBrCH2Br,C发生水解反应生成D为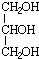 .
. 发生催化氧化生成E为
发生催化氧化生成E为 ,E进一步发生氧化反应生成F为
,E进一步发生氧化反应生成F为 ,F与丙三醇发生缩聚反应生成高聚物.
,F与丙三醇发生缩聚反应生成高聚物.
(1)B为BrCH2CH=CH2,含碳官能团的结构式为: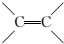 ,C为BrCH2CHBrCH2Br,名称为:1,2,3-三溴丙烷,
,C为BrCH2CHBrCH2Br,名称为:1,2,3-三溴丙烷,
故答案为: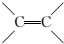 ;1,2,3-三溴丙烷;
;1,2,3-三溴丙烷;
(2)反应①引入碳碳双键,发生消去反应,
故答案为:消去反应:
(3)a.邻苯二甲酸含有羧基,能与碳酸氢钠反应生成二氧化碳,故a正确;
b.邻苯二甲醛含有两个醛基,每分子可与银氨溶液反应生成4个银单质,故b正确;
d.加入硝酸银溶液前,应用适量的稀硝酸中和碱,否则易生成氢氧化银沉淀,故c错误,
故选:ab;
(4)出反应⑤的化学方程式为: ,
,
故答案为: ,
,
(5) 的同分异构体中同时符合下列条件的芳香族化合物:a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀,满足题意的同分异构体中,苯环上应该含有-OH和
的同分异构体中同时符合下列条件的芳香族化合物:a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀,满足题意的同分异构体中,苯环上应该含有-OH和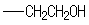

故答案为:6;
(6)根据信息反应,⑥是丙烯与NBS发生取代反应引入溴原子生成G为BrCH2CH=CH2,反应⑦是溴原子在氢氧化钠水溶液、加热条件下被羟基取代,则H为丙烯醇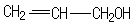
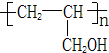 ,
,
故答案为:取代反应;氢氧化钠水溶液; 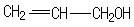
点评 本题考查有机物推断,需要学生对给予的信息进行利用,能较好的考查学生自学能力与迁移运用能力,注意根据转化关系中的物质结构与反应条件进行推断,熟练掌握官能团的性质,难度中等.

| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
(1)⑧在元素周期表中的位置是(周期、族)第二周期第ⅥA族.
(2)8种元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式).
(3)①元素和⑥元素形成化合物的电子式是
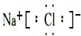 .
.(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:Al(OH)3+3H+═Al3++3H2O.
(5)下列叙述正确的是ABD(填字母).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性.
方案一 样品$\stackrel{CaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
方案二 样品$\stackrel{BaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
下列叙述正确的是( )
| A. | 方案一优于方案二,因为CaCl2比BaCl2更便宜 | |
| B. | 方案一优于方案二,因为其沉淀物溶解度更小沉淀更安全 | |
| C. | 用乙醇洗涤沉淀比用水洗涤,测量结果更准确 | |
| D. | 以上两种方案都必须采集样品的质量、沉淀剂和沉淀物的质量 |
| X | |||
| Z | Y | W |
| A. | X、Y、W的氧化物都属于酸性氧化物 | |
| B. | 工业上采用电解Z的氯化物制备Z单质 | |
| C. | W的单质易溶于XW2 | |
| D. | 1molX或Y的最高价氧化物分子中都含有2mol双键 |
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5.+3.-3 | -2 |
| A. | X.Y元素的金属性:X<Y | |
| B. | Z的最高价含氧酸分子式为H3ZO4 | |
| C. | Y的最高价氧化物对应的水化物能溶于氢氧化钠溶液 | |
| D. | Z的氢化物比W的氢化物稳定 |
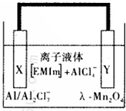 铝是一种高能量载体,是开发电池的理想电极材料.如图所示的室温铝二次电池,采用有机阳离子(EMlm)和 AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 下列说法正确的是( )
铝是一种高能量载体,是开发电池的理想电极材料.如图所示的室温铝二次电池,采用有机阳离子(EMlm)和 AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 下列说法正确的是( )| A. | 电池放电时,Ac-4-向Y极扩散 | |
| B. | 电池放电时,X是正极 | |
| C. | 电池充电时X极的反应为:4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 铝作为负极材料的比能量高于锂 |
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(S) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (ml) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
②反应速率最大的时间段(即0~10S、10~20S、20~30S、30~40S、40~50S…)为40~50S,可能原因是反应放热;
③反应速率最小的时间段为90~100s,可能原因是盐酸浓度降低.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率:
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);
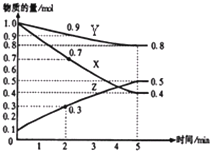
(4)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如右图所示.该反应的化学方程式为:3X+Y?2Z.
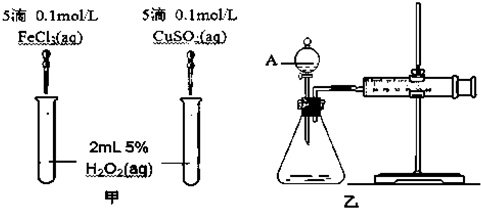
(5)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察生成气泡的快慢判断,
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是产生40ml气体所需要的时间.
 .
.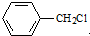 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式:
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式: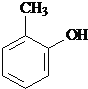 、
、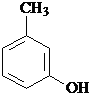 、
、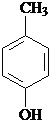 .
.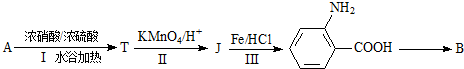
 .
.
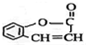 .
. .
.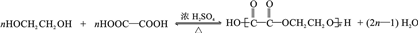 .
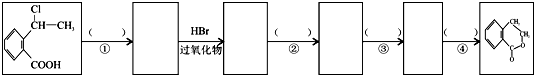
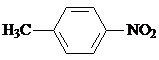
.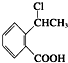 为原料制
为原料制 的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如下:
的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如下: