题目内容
12.向一2L的密闭容器中加入0.2molA和0.2molB,一定条件下容器中发生反应:2A(g)+B(g)?3C(g)+D(g) (△H<0)经过30min反应达到平衡.(1)升高温度,v(正)<v(逆)(填“>”“<”或“=”),平衡逆反应移动(填“正反应”“逆反应”或“不移动”).
(2)加入催化剂,v(正)增大、v(逆)增大(填“增大”“减小”或“不变”)
(3)反应的平衡常数K=$\frac{{c}^{3}(C)}{{c}^{2}(A).c(B)}$(写表达式),升高温度K减小(填“增大”“减小”或“不变”)
(4)若平衡时A的浓度为0.02mol/L,则A的转化率为:80%,反应速率v(C)=0.0405mol/(L.min)mol/(L•min).
(5)若开始时加入0.1mol B、0.3mol C、0.1mol D,保持温度、容积不变,平衡时c(A)=0.02mol/L(填“>”“<”或“=”,下同)
(6)若将容器体积变为1L,保持温度不变再次达到平衡时,c(A)>0.04mol/L.
分析 (1)该反应的正反应是放热反应,升高温度正逆反应速率都增大,但平衡逆向移动;
(2)催化剂能同等程度的改变正逆反应速率;
(3)化学平衡常数K=$\frac{{c}^{3}(C)}{{c}^{2}(A).c(B)}$,该反应的正反应是放热反应,升高温度平衡逆向移动;
(4)平衡时A的浓度为0.02mol/L,剩余A的物质的量=0.02mol/L×2L=0.04mol,A的平均反应速率=$\frac{\frac{0.2mol-0.02mol/L×2L}{2L}}{30min}$=0.0027mol/(L.min),根据同一反应同一时间段内各物质的反应速率之比等于其计量数之比得C的反应速率为;
(5)将D、C完全转化为A、B知,生成A、B物质的量分别是0.2molA、0.1molB,所以与原来加入A、B的物质的量相等,则为等效平衡;
(6)减小容器体积,相当于增大压强,平衡逆向移动.
解答 解:(1)该反应的正反应是放热反应,升高温度正逆反应速率都增大,v(正)<v(逆),平衡向逆反应方向移动,故答案为:<;逆反应;
(2)催化剂能同等程度的增大正逆反应速率但平衡不移动,故答案为:增大;增大;
(3)化学平衡常数K=$\frac{{c}^{3}(C)}{{c}^{2}(A).c(B)}$,该反应的正反应是放热反应,升高温度平衡逆向移动,生成物浓度降低、反应物浓度增大,所以平衡常数减小,
故答案为:$\frac{{c}^{3}(C)}{{c}^{2}(A).c(B)}$;减小;
(4)平衡时A的浓度为0.02mol/L,剩余A的物质的量=0.02mol/L×2L=0.04mol,A的转化率=$\frac{0.2mol-0.04mol}{0.2mol}×100%$=80%,A的平均反应速率=$\frac{\frac{0.2mol-0.02mol/L×2L}{2L}}{30min}$=0.0027mol/(L.min),根据同一反应同一时间段内各物质的反应速率之比等于其计量数之比计算C的反应速率0.0405mol/(L.min),
故答案为:80%;0.0405mol/(L.min);
(5)将D、C完全转化为A、B知,生成A、B物质的量分别是0.2molA、0.1molB,所以与原来加入A、B的物质的量相等,则为等效平衡,所以c(A)=0.02mol/L,
故答案为:=;
(6)减小容器体积,相当于增大压强,平衡逆向移动,则c(A)>0.04mol/L,故答案为:>.
点评 本题考查化学平衡计算、化学平衡影响因素等知识点,侧重考查分析计算能力,会根据反应方程式特点确定平衡移动方向,难点是平衡有关计算,题目难度不大.

| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
(1)⑧在元素周期表中的位置是(周期、族)第二周期第ⅥA族.
(2)8种元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式).
(3)①元素和⑥元素形成化合物的电子式是
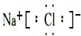 .
.(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:Al(OH)3+3H+═Al3++3H2O.
(5)下列叙述正确的是ABD(填字母).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性.
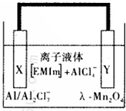 铝是一种高能量载体,是开发电池的理想电极材料.如图所示的室温铝二次电池,采用有机阳离子(EMlm)和 AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 下列说法正确的是( )
铝是一种高能量载体,是开发电池的理想电极材料.如图所示的室温铝二次电池,采用有机阳离子(EMlm)和 AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 下列说法正确的是( )| A. | 电池放电时,Ac-4-向Y极扩散 | |
| B. | 电池放电时,X是正极 | |
| C. | 电池充电时X极的反应为:4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 铝作为负极材料的比能量高于锂 |
| A. | 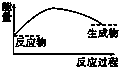 | B. | 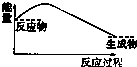 | C. | 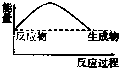 | D. | 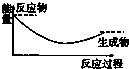 |
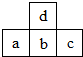 图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是c>b>a>d | |
| B. | c的氢化物比a的氢化物稳定 | |
| C. | b和d可结合成bd32-和bd42-阴离子 | |
| D. | a、b、c的最高价氧化物对应水化物的酸性强弱关系是c>b>a |
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(S) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (ml) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
②反应速率最大的时间段(即0~10S、10~20S、20~30S、30~40S、40~50S…)为40~50S,可能原因是反应放热;
③反应速率最小的时间段为90~100s,可能原因是盐酸浓度降低.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率:
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);
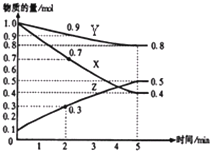
(4)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如右图所示.该反应的化学方程式为:3X+Y?2Z.
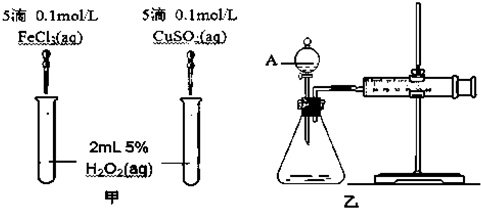
(5)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察生成气泡的快慢判断,
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是产生40ml气体所需要的时间.
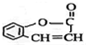 .
. .
.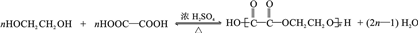 .
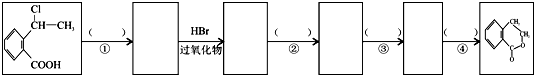
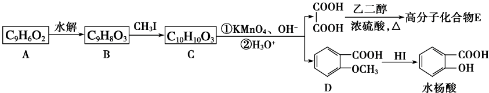
.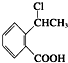 为原料制
为原料制 的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如下:
的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如下: