题目内容
绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下: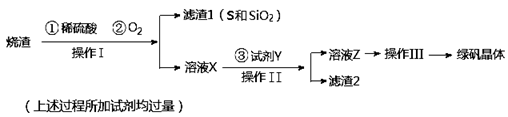
试回答:
(1)操作I为 (填写操作名称)。
(2)试剂Y与溶液X反应的离子方程式为 。
(3)操作III的顺序依次为: 、冷却结晶、过滤、 、干燥。
(4)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
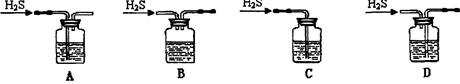
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需 。②该同学设计的下列滴定方式,最合理的是 (夹持部分略去)(填字母序号)。
③滴定时发生反应的离子方程式为: 。
④判断此滴定实验达到终点的方法是 ;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果 (填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为 。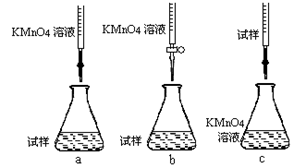
(1)过滤(1分) (2)Fe+2Fe3+=3Fe2+(1分) Fe+2H+=Fe2++H2↑(1分)
(3)蒸发浓缩(1分)、洗涤(1分) (4)①1000mL容量瓶 (1分)②b(1分)
③5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分)
④滴加最后一滴KMnO4溶液时,溶液变成紫色且半分钟内不再褪色(2分)偏低(2分)
⑤ 96.7%(2分)
解析试题分析:(1)由于烧渣中含有与稀硫酸以及氧气不反应的二氧化硅,所以操作I是过滤。
(2)由于滤液中含有铁离子以及过量的稀硫酸。而最终制备的是绿矾,所以需要将溶液中的铁离子还原为亚铁离子,因此试剂Y是铁粉,所以有关反应的离子方程式为Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑。
(3)操作Ⅲ的目的是得到绿矾晶体,所以正确的操作应该是蒸发浓缩、冷却结晶、过滤、洗涤然后干燥即可。
(4)①准确配制一定物质的量浓度溶液的主要仪器是容量瓶,所以步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需1000ml容量瓶。
②由于酸性高锰酸钾溶液具有强氧化性与酸性,因此应该放在酸式滴定管中,答案选b。
③酸性高锰酸钾溶液具有强氧化性,能把亚铁离子氧化生成铁离子,而自身被还原为Mn2+,因此该反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
④由于酸性高锰酸钾溶液显紫红色,所以判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成紫色且半分钟内不再褪色;由于滴定管的刻度自上而下逐渐增大,所以若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,则读数值偏小。如果其它操作均正确,则使测定结果偏低。
⑤根据反应式可知,反应中消耗亚铁离子的物质的量=0.01000mol/L×0.02000L×5=0.001mol,则原样品中绿矾的物质的量=0.001mol×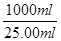 =0.04mol,质量=0.04mol×278g/mol=11.12g,所以上述样品中FeSO4·7H2O的质量分数为
=0.04mol,质量=0.04mol×278g/mol=11.12g,所以上述样品中FeSO4·7H2O的质量分数为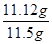 ×100%=96.7%。
×100%=96.7%。
考点:考查绿矾晶体制备、物质的分离与提纯、一定物质的量浓度计算、氧化还原反应滴定、计算以及误差分析

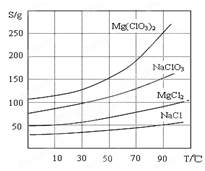
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。
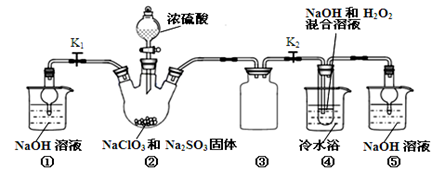
某兴趣小组用如图所示装置进行Mg与SO2反应的实验。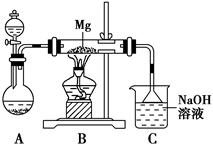
(1)选择制取SO2的合适试剂________(填编号)。
①浓HCl ②浓H2SO4 ③Na2SO3固体 ④CaSO3固体
(2)上述装置还可优化,优化的方法是________________________________________,装置C中NaOH溶液的作用是___________________________________________________________
(3)甲同学推测Mg与SO2的反应和Mg与CO2的反应相似,则该反应方程式为_________________________________________;
乙同学的推测是:2Mg+3SO2 2MgSO3+S;丙同学的推测是:3Mg+SO2
2MgSO3+S;丙同学的推测是:3Mg+SO2 2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀。
限选试剂:2 mol·L-1盐酸、2 mol·L-1硝酸、蒸馏水、2 mol·L-1 NaOH溶液、品红溶液、澄清石灰水、2 mol·L-1 CuSO4溶液;仪器和用品自选。
| 序号 | 实验步骤 | 预期现象和结论 |
| ① | 取少量反应后所得固体于试管中 | |
| ② | 向试管中的固体慢慢滴加____________,试管口塞上带导管的单孔塞,并将导管通入盛有________的试管中 | 若试管中的________,则丙同学推测正确,若试管中的固体未完全溶解,且________,则乙同学推测正确 |
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是
_____________________________________________________________。
(4)上述实验需要100 mL 2 mol·L-1的盐酸,配制时选用________(选填10 mL、25 mL、50 mL或100 mL)量筒量取36.5%密度为1.19 g·mL-1的浓盐酸的体积为________mL。
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:①在酸性条件下,I- 能被NO3- 氧化成IO3-,被H2O2或O2等氧化为I2;② IO3- 能被HSO3- 还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、IO3- 中的哪一种。
限选试剂如下:1.0 mol?L-1HNO3溶液、1.0 mol?L-1H2SO4溶液、1.0 mol?L-1NaHSO3溶液、3%H2O2溶液、1%淀粉溶液、蒸馏水。
(1)提出假设
假设1:该食盐样品中含I2;
假设2:该食盐样品中含I-;
假设3: 。
(2)设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表:
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液,振荡 | 若溶液显 (填颜色),则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: | 若溶液显蓝色,则假设2成立,反应的离子方程式为 ;否则,假设2不成立,再进行步骤3 |
| 步骤3: | |
(3)问题与思考
纯KIO3或纯KI都可以作为食用加碘盐中碘的来源。从化学角度来看,实验中添加 (填“KIO3”或“KI”)更好,理由是 。

 NH4F+ H2SiO3↓+ CO2↑+
NH4F+ H2SiO3↓+ CO2↑+ 
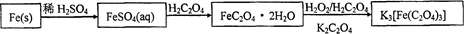
 溶液
溶液
 得固体b g
得固体b g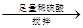
 量气测得气体体积Va mL
量气测得气体体积Va mL 250 mL溶液
250 mL溶液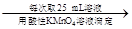 三次平均消耗0.1 mol·L-1酸性KMnO4溶液Vb mL你认为以上方案中 无法确定样品的组成,理由是 。
三次平均消耗0.1 mol·L-1酸性KMnO4溶液Vb mL你认为以上方案中 无法确定样品的组成,理由是 。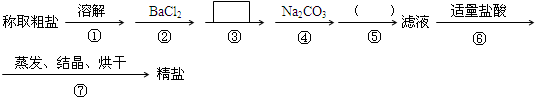
 中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。
中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。