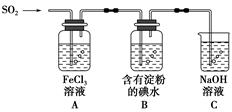
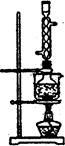
题目内容
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。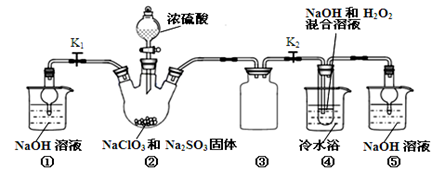
完成下列填空:
(1)装置②中产生ClO2的化学方程式为 。装置③的作用是 。
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品。
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+ 4I-+4H+ →2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。配制待测液需用到的定量玻璃仪器是 ;
(4)取25.00mL待测液,用2.0 mol/L Na2S2O3标准液滴定(I2 +2S2O32-→2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为 。重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL。该样品中NaClO2的质量分数为 。
(5)通过分析说明装置①在本实验中的作用 。
(1)2NaClO3 + Na2SO3 + H2SO4→2ClO2 + 2Na2SO4 + H2O(2分)防止倒吸。
(2)趁热过滤;用38-60℃的温水洗涤
(3)250mL容量瓶;(2分)
(4)溶液由蓝色变为无色且半分钟内不变色。90.5%(2分)
(5)当关闭K2时,打开K1,可以吸收反应产生的气体。(2分)
解析试题分析:(1)根据反应物NaClO3、Na2SO3、H2SO4,生成物为ClO2和2Na2SO4,配平方程式为2NaClO3 + Na2SO3 + H2SO4=2ClO2 + 2Na2SO4 + H2O;装置③为安全瓶,防止装置②中气体温度降低而产生倒吸;
(2)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤;用38-60℃的温水洗涤;
(3)容量瓶要指明规格;
(4)有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,终点溶液由蓝色变为无色且半分钟内不变色;
计算时一般找出关系式,由此进行计算,关系式为ClO2-——2I2——4S2O32-
n(ClO2-)= 1/4 n(S2O32-)=1/4×20×10-3×2=0.01mol
m(NaClO2)=0.01×90.5=9.05g 该样品中NaClO2的质量分数为9.05g÷10g=0.905
(5)本实验产生污染性气体,直接排放会污染环境,故需要尾气处理,装置①就是用碱吸收反应产生的ClO2等尾气。
考点:考查物质的制备及实验分析等有关问题。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案乙酰水杨酸俗称阿司匹林(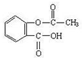 ),是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
),是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:


制备基本操作流程如下:
主要试剂和产品的物理常数如下表:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
回答下列问题:
(1)合成阿司匹林时,最合适的加热方法是 。
(2)合成阿司匹林时,必须使用干燥的仪器,其原因是 。
(3)减压过滤所得粗产品要用少量冰水洗涤,其目的是 。
(4)用重结晶方法提纯粗产品流程如下,加热回流程装置如图。


①沸石的作用是 ;
②冷凝水的流进方向是 (填“a”或“b”);
③使用温度计的目的是 。
(5)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(
 ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 (百分数精确到0.1)。
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 (百分数精确到0.1)。 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为________________。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | ①气体成分为________ |
| 实验Ⅲ | ②取实验Ⅰ中的白色不溶物,洗涤,加入足量________ | ③________________ __________________ __________________ | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | ④溶液中存在________ |
(3)为进一步确定实验Ⅰ的产物,设计定量实验方案,如图所示:

称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重1.8 g,装置B增重8.8 g,试确定白色不溶物的化学式:__________________________ ______________________________________________。
(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:____________________________________。
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂。制备硝基苯的过程如下:①配制混酸:组装如下图反应装置。
取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中。把18 mL苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。
③在50-60℃下发生反应,直至反应结束。
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
已知(1)

(2)可能用到的有关数据列表如下
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃) / g·cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 |  | 83 | 1.4 | 易溶于水 |
| 浓硫酸 |  | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)配置混酸应先在烧杯中先加入 。
(2)恒压滴液漏斗的优点是 。
(3)实验装置中长玻璃管可用 代替(填仪器名称)。
(4)反应结束后产品在液体的 层(填“上”或者“下”),分离混酸和产品的操作方法为 。
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? 。
(6)为了得到更纯净的硝基苯,还须先向液体中加入 除去水,然后蒸馏,