题目内容
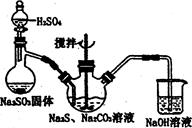
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
(1)判断BaCl2已过量的方法是 。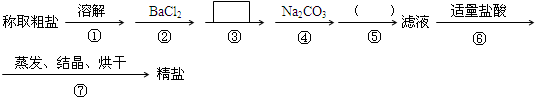
(2)第④步中,写出相应的离子方程式: ; ____________________________.
(3)在 中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。
中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。
(4)从实验设计方案优化的角度分析步骤②和④可否颠倒____________(填“是”或“否”,如果“否”,请说明理由。)原因是:_______________________ _______ _________________;
步骤③和④可否颠倒____________。
(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是: 。
(14分)(1)取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(3分)(合理答案皆可)
(2)Ca2+ + CO32- = CaCO3↓; Ba2+ + CO32- = BaCO3↓(4分)
(3)NaOH 过滤 (2分)
(4)否;过量的BaCl2必须要用Na2CO3除去,步骤复杂; 是 ;(3分)
(5)会有部分沉淀溶解,从而影响制得精盐的纯度(2分)
解析试题分析:(1)取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量。
(2)②步骤中BaCl2过量,所以③步骤溶液中含有阳离子Ba2+、Ca2+, Ba2+、Ca2+遇CO32-沉淀,离子反应方程式如下:Ca2+ + CO32- = CaCO3↓; Ba2+ + CO32- = BaCO3↓。
(3)NaOH为除去Mg2+。过滤是为了除去沉淀。
(4)步骤②和④如果颠倒就会有多余的Ba2+未被除去。
(5)会有部分沉淀溶解,从而影响制得精盐的纯度。
考点:本题着重考查粗盐提取实验。

 走进文言文系列答案
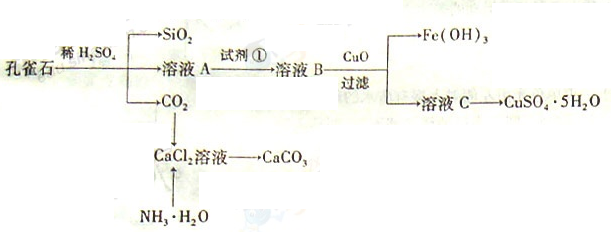
走进文言文系列答案海洋约占地球表面积的71%,海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下:
① 试剂①宜选用石灰乳且必须过量,过量的目的是 .
② 镁蒸气宜在 (填序号)气体冷却后得到镁锭
| A.N2 | B.CO2 | C.Ar | D.空气) |

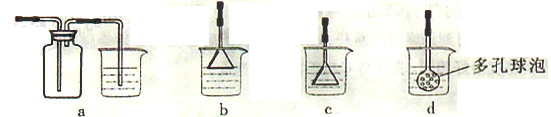
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):

③A装置中通入a气体时,反应的离子方程式表示为: .
④A装置中通入a气体一段时间后,
停止通入,改通热空气。通入热空气的目的是: .
⑤反应过程中,B装置中产生的两种主要阴离子为 .
⑥C装置的作用是 。
废易拉罐的成分比较复杂,据查,铝易拉罐各部分成分及含量(质量百分含量)见表:
| | Si | Fe | Cu | Mn | Mg | Cr | Zn | Ti | Al |
| 罐身/% | 0.3 | 0.7 | 0.25 | 0.25 | 1.0~1.5 | | | | 其余 |
| 罐盖/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 4.0~5.0 | | 0.1 | 0.25 | 其余 |
| 拉环/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 3.0~4.0 | 0.1 | 0.25 | 0.1 | 其余 |
为了验证罐身的组成成分,进行了如下实验:
【实验仪器与药品】
仪器:酒精灯、烧杯、试管、试管夹、漏斗、滤纸、铁圈、玻璃棒、砂纸、剪刀
药品:易拉罐、去污粉、NaOH溶液、KSCN溶液、盐酸、镁试剂、高碘酸(H3IO6,弱酸)
【实验方案】
实验预处理:将剪好的易拉罐片用砂纸打磨,除去表面的涂料层,直到光亮后用去污粉清洗干净备用。
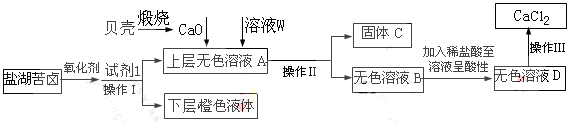
【实验过程】分别向试管a、b中加入少量上述易拉罐片,进行如下操作:
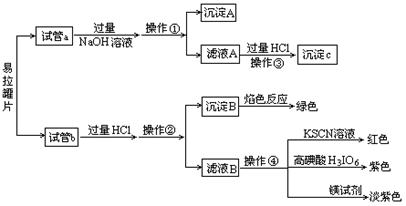
请填写下列空白:
(1)图中操作①②所用到的玻璃仪器有 。
(2)沉淀A的成分为 。
(3)操作③观察到的现象为 ;反应的离子方程式为 、
、 。
(4)若试管a、b中取样相同,则分别加入足量的NaOH溶液、稀盐酸后,相同条件下理论上产生的气体体积V(a) V(b)(填“>”、“<”或“=”)
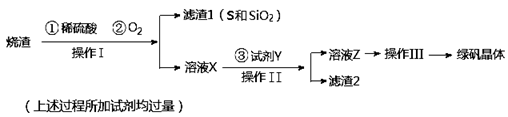

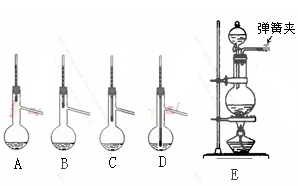



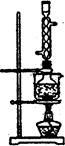
 CH3CH2CH2CHO
CH3CH2CH2CHO CH3CH2CH2CH2OH;CO的制备原理:HCOOH
CH3CH2CH2CH2OH;CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
