题目内容
易溶于水的三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。以铁屑为原料的制备流程如下: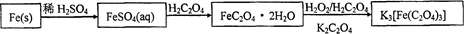
请回答下列问题:
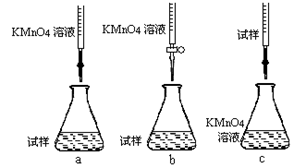
(1)铁屑中常含硫元素,加稀硫酸时会产生有毒的H2S气体,可用氢氧化钠溶液吸收,下列吸收装置正确的是 。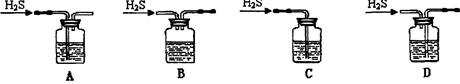
(2)制得的FeSO4溶液中需加入少量的H2SO4酸化,目的是 。若要从溶液中得到绿矾FeSO4·7H2O,必须进行的实验操作是 (按顺序填写)。
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
(3)该晶体盐在110℃可完全失去结晶水,继续升高温度可发生分解反应。
①分解得到的气体产物用如下装置进行实验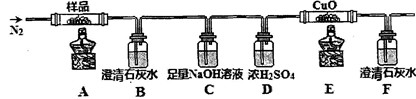
装置检查气密性后,先通一段时间N2,其目的为 。结束实验时先熄灭酒精灯再通入N2至常温,其目的为 。实验过程中观察到B、F中澄清石灰水都变浑浊,E中有红色固体生成,则气体产物是 。
②分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。现设计下列三种实验方案对该样品进行物质含量测定。
【甲】a g样品 溶液
溶液
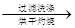 得固体b g
得固体b g
【乙】a g样品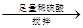
 量气测得气体体积Va mL
量气测得气体体积Va mL
【丙】a g样品 250 mL溶液
250 mL溶液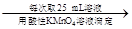 三次平均消耗0.1 mol·L-1酸性KMnO4溶液Vb mL你认为以上方案中 无法确定样品的组成,理由是 。
三次平均消耗0.1 mol·L-1酸性KMnO4溶液Vb mL你认为以上方案中 无法确定样品的组成,理由是 。
(1)A (2)防止Fe2+的水解 b c a e
(3)①排出装置中的空气, 防止干扰实验结果 防止液体回流(或倒吸) CO2、CO
②丙方案 使用盐酸溶解样品,氯离子也可被酸性MnO4-氧化
解析试题分析:(1)吸收杂质气体时导气管的连接方式是长进短出,而且长的导气管要浸没在液面下,短的导气管稍微露出橡胶塞即可。故选项为A。(2)制得的FeSO4溶液中需加入少量的H2SO4酸化,目的是防止Fe2+的水解而使溶液变浑浊。若要从溶液中得到绿矾FeSO4·7H2O,必须进行的实验操作是蒸发浓缩、冷却结晶、过滤洗涤、干燥。故选项为 b c a e。(3)①装置检查气密性后,要先通一段时间N2,其目的为了排出装置中的空气, 防止干扰实验结果。实验过程中观察到B中澄清石灰水变浑浊说明含有CO2,E中有红色固体生成,F中的澄清石灰水变浑浊则说明气体产物含有CO。所以气体产物是CO2、CO。②分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。甲:样品ag,加入足量的硝酸溶解得到Fe(NO3)3,向溶液中加入足量的NaOH溶液得到Fe(OH)3沉淀,将其过滤出来洗涤干净,然后灼烧,发生反应:2Fe(OH)3 Fe2O3+3H2O.烘干得到的固体质量就是Fe2O3的质量。进而计算出Fe元素的质量。因此再根据含铁样品的质量及Fe的质量就是出固体产物个组分的含量。正确。乙:向含铁样品中加入足量的稀硫酸发生反应:Fe+H2SO4=FeSO4+H2↑。根据放出的氢气的体积可计算出Fe的质量,继而求出FeO的质量,固体样品中个组分的含量得到求解。正确。丙:样品用足量的盐酸溶解时发生反应:Fe+2HCl=FeCl2+H2↑;FeO+2HCl=FeCl2+H2O.取25ml的溶液用酸性KMnO4溶液滴定时Fe2+、Cl-都被酸性高锰酸钾氧化,因此不能根据消耗的高锰酸钾溶液的物质的量的多少来确定溶液中Fe2+的多少。故不能确定样品中个组分含量的多少。错误。因此在这三种方案中丙无法确定物质的组成。
Fe2O3+3H2O.烘干得到的固体质量就是Fe2O3的质量。进而计算出Fe元素的质量。因此再根据含铁样品的质量及Fe的质量就是出固体产物个组分的含量。正确。乙:向含铁样品中加入足量的稀硫酸发生反应:Fe+H2SO4=FeSO4+H2↑。根据放出的氢气的体积可计算出Fe的质量,继而求出FeO的质量,固体样品中个组分的含量得到求解。正确。丙:样品用足量的盐酸溶解时发生反应:Fe+2HCl=FeCl2+H2↑;FeO+2HCl=FeCl2+H2O.取25ml的溶液用酸性KMnO4溶液滴定时Fe2+、Cl-都被酸性高锰酸钾氧化,因此不能根据消耗的高锰酸钾溶液的物质的量的多少来确定溶液中Fe2+的多少。故不能确定样品中个组分含量的多少。错误。因此在这三种方案中丙无法确定物质的组成。
考点:考查除杂装置的选择、混合物分离的实验步骤及混合物中个组分含量的测定方法等知识。

 天天向上口算本系列答案
天天向上口算本系列答案正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:
CH3CH2CH2CH2OH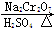 CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2 Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0 g。
回答下列问题:
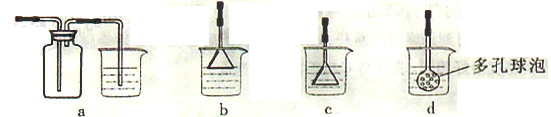
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由______________________。
(2)加入沸石的作用是________。若加热后发现未加沸石,应采取的正确方法是________。
(3)上述装置图中,B仪器的名称是________,D仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分离水时,水在________层(填“上”或“下”)。
(6)反应温度应保持在90~95℃,其原因是__________________________________。
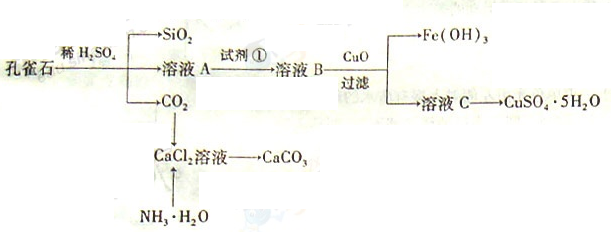
对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂、浓硫酸为催化剂,通过甲苯的硝化反应制备。
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45 ℃反应1 h。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是_____________________________________。
(2)滤液在分液漏斗中洗涤静置后,有机层处于________层(填“上”或“下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有_________________________________________________________。
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 |  | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
| 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | |||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为________。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是_________________________________________________________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有________________、________________。
下图是实验室制备1,2—二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。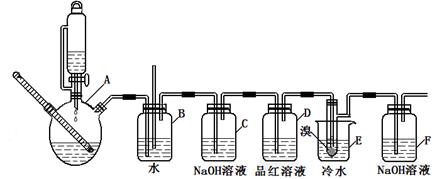
有关数据列表如下:
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:____________________________________________________________。
(2)气体发生装置使用连通滴液漏斗的原因_________________________________________。
(3)装置D中品红溶液的作用是_______________;同时B装置是安全瓶,监测实验进行时E中是否发生堵塞,请写出堵塞时的现象_______________________________________。
(4)反应过程中应用冷水冷却装置E,其主要目的是___________________________;但又不能过度冷却(如用冰水),其原因是_____________________________________________。
(5)判断该制备反应已经结束的方法是__________________;结果学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是_______________________________________。
(6)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行______(填“是”或“否”),其原因是____________________________。
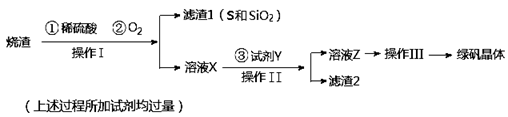
海洋约占地球表面积的71%,海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下:
① 试剂①宜选用石灰乳且必须过量,过量的目的是 .
② 镁蒸气宜在 (填序号)气体冷却后得到镁锭
| A.N2 | B.CO2 | C.Ar | D.空气) |

某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):

③A装置中通入a气体时,反应的离子方程式表示为: .
④A装置中通入a气体一段时间后,
停止通入,改通热空气。通入热空气的目的是: .
⑤反应过程中,B装置中产生的两种主要阴离子为 .
⑥C装置的作用是 。