题目内容
已知反应:2NO2(红棕色) 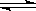 N204(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N204(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
A.b点的操作是拉伸注射器
B.d点:v(正)>v(逆)
C.c点与a点相比,c(N02)增大,c(N204)减小,若容器绝热则平衡常数Ka>Kc
D.若不忽略体系温度变化,且没有能量损失,则T(b)<T(c)
练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
4.下列化学用语使用不正确的是( )
| A. | Na+的结构示意图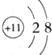 | |
| B. | 聚乙烯的结构简式为CH2=CH2 | |
| C. | 纯碱的化学式为Na2CO3 | |
| D. | 高氯酸(HClO4)中氯元素的化合价为+7 |
5.在2L的容器里有某反应物4mol,反应进行2秒后,该反应物还剩3.2mol,则该反应的平均速率为( )(mol•L-1•s-1)
| A. | 0.1 | B. | 0.2 | C. | 0.4 | D. | 0.8 |
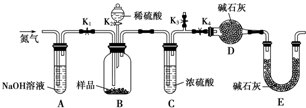
2.某研究性学校小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查)
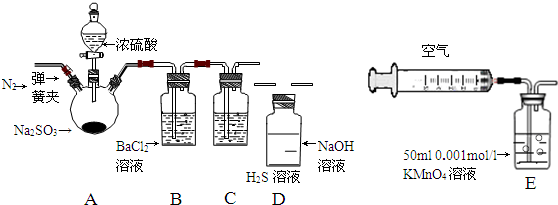
(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是排除装置中氧气对实验的干扰.
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中.向第1支试管中滴加适量氨水出现白色沉淀BaSO3(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有氧化性.
(5)装置D的作用是吸收SO2尾气,防止污染空气.
(6)实验后,测定装置D中溶液呈碱性.溶液为什么呈碱性呢?大家有两种不同的假设:
①生成的Na2SO3水解产生OH-(SO32-+H2O?HSO3+OH-);②氢氧化钠剩余.请设计实验方案证明哪种假设成立.可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸

(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是排除装置中氧气对实验的干扰.
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中.向第1支试管中滴加适量氨水出现白色沉淀BaSO3(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有氧化性.
(5)装置D的作用是吸收SO2尾气,防止污染空气.
(6)实验后,测定装置D中溶液呈碱性.溶液为什么呈碱性呢?大家有两种不同的假设:
①生成的Na2SO3水解产生OH-(SO32-+H2O?HSO3+OH-);②氢氧化钠剩余.请设计实验方案证明哪种假设成立.可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量溶液于试管,滴入几滴酚酞 | 溶液变红 |
| 2 | 然后加入足量的BaCl2溶液 | 溶液中产生白色沉淀,最后若红色褪去,则说明①正确;若红色不能褪去,则说明②正确 |


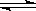 CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.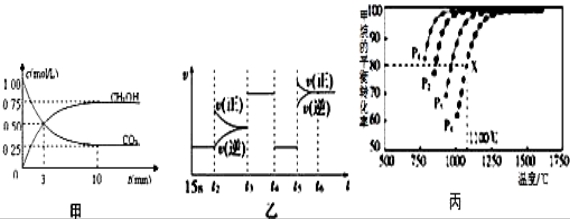
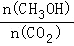 增大的是___________.
增大的是___________. 条件是_____________.(填序号)
条件是_____________.(填序号) p C(g) △H,在密闭容器中进行,如图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )
p C(g) △H,在密闭容器中进行,如图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )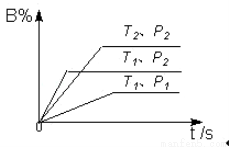
 1<T2,P1>P2,m+n>p,△H<0
1<T2,P1>P2,m+n>p,△H<0 C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是