题目内容
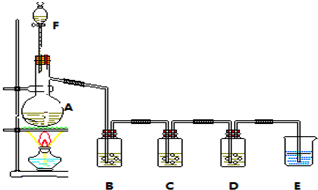
2.某研究性学校小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查)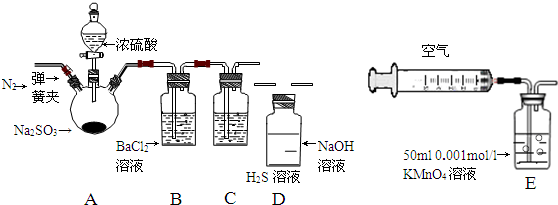
(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是排除装置中氧气对实验的干扰.
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中.向第1支试管中滴加适量氨水出现白色沉淀BaSO3(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有氧化性.
(5)装置D的作用是吸收SO2尾气,防止污染空气.
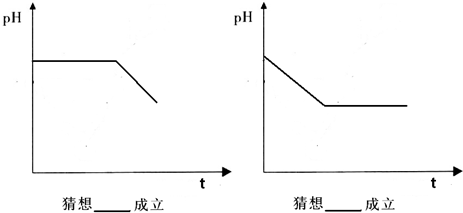
(6)实验后,测定装置D中溶液呈碱性.溶液为什么呈碱性呢?大家有两种不同的假设:
①生成的Na2SO3水解产生OH-(SO32-+H2O?HSO3+OH-);②氢氧化钠剩余.请设计实验方案证明哪种假设成立.可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量溶液于试管,滴入几滴酚酞 | 溶液变红 |
| 2 | 然后加入足量的BaCl2溶液 | 溶液中产生白色沉淀,最后若红色褪去,则说明①正确;若红色不能褪去,则说明②正确 |
分析 (1)装置A中亚硫酸钠和浓硫酸反应生成硫酸钠、二氧化硫气体和水,据此写出反应的化学方程式;
(2)装置中氧气影响测定,需要用氮气除去杂质中的空气;
(3)二氧化硫易溶于水,但是二氧化硫不与氯化钡溶液反应,当向溶液中通入氨气后生成亚硫酸铵,亚硫酸铵溶液与氯化钡反应生成亚硫酸钡;氯气具有强氧化性,氯气将二氧化硫氧化成硫酸,硫酸与氯化钡反应生成氯化钡沉淀,据此写出反应的离子方程式;
(4)二氧化硫与硫化氢反应生成淡黄色的S单质,二氧化硫表现了氧化性;
(5)二氧化硫有毒,多余的气体需要用氢氧化钠溶液吸收;
(6)向实验1的溶液中加入足量氯化钡溶液,根据溶液颜色变化判断.
解答 解:(1)装置A中亚硫酸钠和浓硫酸反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)装置中的氧气影响二氧化硫含量的测定,所以为了排除装置中空气,应该滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹,
故答案为:排除装置中氧气对实验的干扰;
(3)向第1支试管中滴加适量氨水,氨水与二氧化硫反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成亚硫酸钡白色沉淀;氯气将二氧化硫氧化成硫酸,硫酸与钡离子反应生成硫酸钡沉淀,反应的离子方程式为:Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-,
故答案为:BaSO3;Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-;
(4)C中发生反应为:2H2S+SO2=3S↓+2H2O,反应中二氧化硫得电子化合价降低而作氧化剂,表现了氧化性,
故答案为:氧化;
(5)二氧化硫气体是一种有毒气的酸性氧化物,多余的气体不能直接排放,需要用氢氧化钠溶液吸收,
故答案为:吸收SO2尾气,防止污染空气;
(6)取少量溶液于试管,滴入几滴酚酞,溶液变成红色,然后向该溶液中然后加入足量的BaCl2溶液,溶液中产生白色沉淀,若最后红色褪去,则说明①正确,若红色不能褪去,则说明②正确,故答案为:
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 2 | 然后加入足量的BaCl2溶液 | 溶液中产生白色沉淀,最后若红色褪去,则说明①正确;若红色不能褪去,则说明②正确 |
点评 本题考查了探究物质性质、测量物质含量的方法,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力,明确实验原理及化学实验基本操作方法为解答关键,(6)为易错点,注意性质实验方案的设计与评价原则.

| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | NO2与水反应氧化剂与还原剂物质的量比为2:1 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 铁露置在空气中一段时间后会生锈;性质更活泼的铝不能稳定存在于空气中 |
| A. | 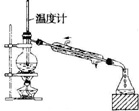 蒸馏石油 | B. | 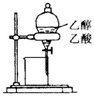 除去乙醇中的乙酸 | ||
| C. | 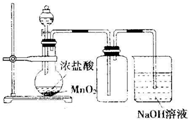 实验室制氯气 | D. | 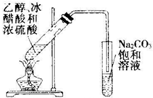 实验室制乙酸乙酯 |
用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含 量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。
量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。
(1)滴定时应选用  作指示剂;
作指示剂;
(2)判断到达滴定终点的实验现象是  。
。
(3)下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴 定前有气泡,滴定后气泡消失
定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数
(4)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加 入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol·
入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol· L-1的盐酸标准液进行滴定,相关数据记录如下:
L-1的盐酸标准液进行滴定,相关数据记录如下:
实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
初读数 | 末读数 | ||
1 | 20.00 | 0.80 | 21.00 |
2 | 20.00 | 1.00 | 20.80 |
3 | 20.00 | 0.20 | 22.80 |
依据表中数据,计算出烧碱样品中含NaOH的质量分数为 。(小数点后保留两位数字)
(1)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)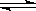 CH3OH(g)+H2O(g)△H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g)△H1=-49.1kJ·mol-1
2CH3OH(g)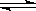 CH3OCH3
CH3OCH3 (g)+H2O(g)△H2=-24.5kJ·mol-1
(g)+H2O(g)△H2=-24.5kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式  。
。
(2)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
①已知反应2HI(g)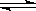 H2(g) + I2(g)的△H= + 11kJ•mol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、1
H2(g) + I2(g)的△H= + 11kJ•mol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、1 51KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_________kJ。
51KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_________kJ。
②Bodensteins研究了下列反应:2HI(g)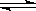 H2(g)+I2(g)
H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
X(HI) | 0 | 0.60 | 0.73 |
| 0.780 | 0.784 |
根据上述实验结果,该反应的平衡常数K的计算式为: 。上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2 ),其中k正、k逆为速率常数,则k
),其中k正、k逆为速率常数,则k 逆为 (以K和k正表示)。若k正=0.0027min﹣1,在t=40min时,v正= min﹣1。
逆为 (以K和k正表示)。若k正=0.0027min﹣1,在t=40min时,v正= min﹣1。
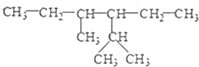 的系统命名为:2,4-二甲基-3-乙基乙烷
的系统命名为:2,4-二甲基-3-乙基乙烷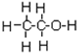 ,乙烯的电子式为
,乙烯的电子式为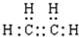
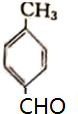 <
<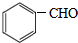
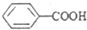 >CH3COOH(提示:类比酚与醇的酸性)
>CH3COOH(提示:类比酚与醇的酸性)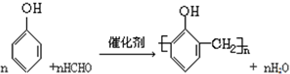
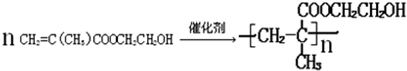 .
. N204(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N204(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )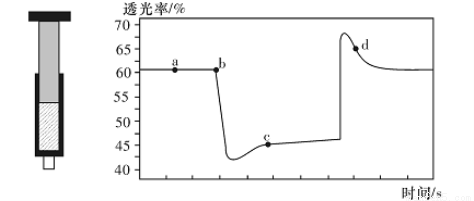
 0.773
0.773