题目内容
17.分析、归纳、探究是学习化学的重要方法和手段之一.下面就电解质A回答有关问题(假定以下都是室温时的溶液).(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a.
①试说明HnB的酸性强弱当a=7时,HnB为强酸,当a>7时HnB为弱酸.
②当a=10时,A溶液呈碱性的原因是(用离子方式程式表示)Bn-+H2O?HB(n-1)-+OH-.
③当a=10、n=1时,A溶液中各种离子浓度由大到小的顺序为c(Na+)>c(B-)>c(OH-)>c(H+).c(OH-)-c(HB)=10-10 mol/L.
④当n=1、c=0.1、溶液中c(HB):c(B-)=1:99时,A溶液的pH为11(保留整数值).
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρ g/cm3,Xm+离子的浓度为c mol/L,则该难溶物XnYm的溶度积常数为Ksp=($\frac{m}{n}$)m•cm+n,该温度下XnYm的溶解度S=$\frac{100cM}{1000ρn-cM}$.
分析 (1)①依据盐溶液PH分析判断对应酸碱的强弱,弱离子水解盐溶液显示了酸碱性;
②依据盐类水解的实质分析书写离子方程式;
③根据溶液中的pH、电荷守恒、物料守恒、盐的水解原理进行分析、计算、比较离子浓度大小;
④根据c(HB):c(B-)=1:99计算出水解生成氢氧根离子的浓度,再根据水的离子积计算出溶液中氢离子的浓度,然后计算pH;
(2)根据电解质A的化学式写出溶解平衡,根据溶度积常数表达式及题数中数据 计算出该难溶物XnYm的溶度积常数为Ksp,依据溶解度概念计算溶解度,计算100g水达到饱和溶解溶质质量.
解答 解:(1)①电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a.当a=7说明是强酸强碱盐,HnB为强酸,当a大于7,NanB为强碱弱酸盐,在溶液中发生了水解:Bn-+H2O?HB(n-1)-+OH-,HnB为弱酸,
故答案为:当a=7时,HnB为强酸,当a>7时HnB为弱酸;
②NanB溶液的pH=10,NanB为强碱弱酸盐,在溶液中发生了水解:Bn-+H2O?HB(n-1)-+OH-;
故答案为:Bn-+H2O?HB(n-1)-+OH-;
③当a=10,n=1时,由于B-离子水解,溶液呈碱性,溶液中B-离子浓度减小,小于溶液中钠离子的浓度,水解是少量的,所以A溶液中各种离子浓度由大到小的顺序为:c(Na+)>c(B-)>c(OH-)>c(H+);
溶液中存在电荷守恒:c(B-)+c(OH-)=c(H+)+c(Na+);
物料守恒:c(Na+)=c(HB)+c(B-);
将钠离子浓度带入电荷守恒可得:c(B-)+c(OH-)=c(H+)+c(HB)+c(B-),c(OH-)-c(HB)=c(H+)=1×10-10mol/L;
故答案为:c(Na+)>c(B-)>c(OH-)>c(H+);1×10-10 mol/L;
③当n=1、c=0.1,溶液中c(HB):c(B-)=1:99时,参与水解的B-离子为1%,水解生成氢氧根离子浓度为:0.1mol/L×1%=0.001mol/L,则C(H+)=$\frac{1{0}^{-14}}{1{0}^{-3}}$=1O-11(mol/L),所以溶液的pH为11;
故答案为:11;
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρ g/cm3,Xm+离子的浓度为c mol/L,XnYm的溶解平衡为:XnYm(s)?nXm+(aq)+mYn-(aq),Xm+离子的浓度为c mol/L,Yn-的浓度为$\frac{cm}{n}$mol/L,Ksp=cn(Xm+)×cm(Yn-)=cn×($\frac{cm}{n}$)m=($\frac{m}{n}$)m•cm+n,
溶液为1L,溶液质量=1000×ρg/ml=1000ρg,溶质物质的量=$\frac{c}{n}$mol/L×1L×Mg/mol,溶解度S=100×$\frac{\frac{c}{n}M}{1000ρ-\frac{c}{n}×M}$=$\frac{100cM}{1000ρn-cM}$,
该温度下XnYm的溶解度S=$\frac{100cM}{1000ρn-cM}$;
故答案为:($\frac{m}{n}$)m•cm+n,$\frac{100cM}{1000ρn-cM}$;
点评 本题考查了溶液pH的简单计算、溶液中离子浓度大小比较、难溶电解质的溶解平衡等知识,题目难度较大,注意掌握溶液中电荷守恒和物料守恒的应用,明确pH计算方法、溶度积常数的含义及计算方法是解题关键.

| A. | 一种元素可能形成多种氧化物,但同价态的氧化物只有一种 | |
| B. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| C. | 已知K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾,则BaO2的名称是过氧化钡 | |
| D. | 由共价键形成的物质一定是共价化合物 |
| A. | 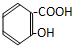 | B. | 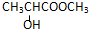 | ||
| C. | CH2=CH-COOH | D. | 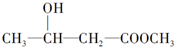 |
(1)已知该反应为放热反应,下图能正确表示该反应中能量变化的是A.
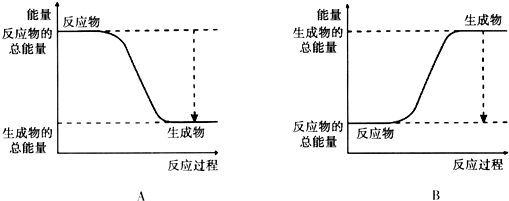
(2)从断键和成键的角度分析上述反应中能量的变化.已知:化学键的键能:
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
(3)已知1克氢气完全燃烧生成液态水放出QKJ的热量,则氢气燃烧生成液态水的热化学反应方程式为2H2 (g)+O2(g)=2H2O(l)△H=-4QKJ/mol
(4)氢氧燃料电池的总反应方程式为2H2+O2═2H2O.电路中每转移0.2mol电子,标准状况下消耗H2的体积是2.24L.
| A. | 加热蒸干MgCl2饱和溶液,可制得氯化镁固体 | |
| B. | 明矾可用于水的消毒、杀菌 | |
| C. | 使用无磷洗衣粉,可缓解水体富营养化问题 | |
| D. | 用加热法可除去硬水中的CaCl2、MgCl2 |
| A. | 常温常压下,2.24L 氯气与氢氧化钠溶液完全反应转移的电子数为0.1NA | |
| B. | 标准状况下,1L辛烷完全燃烧后,所生成气体产物的分子数为8NA/22.4 | |
| C. | 0.1L 2mol•L-1的(NH4)2S溶液中含有的S2-数目为0.2 NA | |
| D. | 在含有4mol Si-O键的石英晶体中,氧原子的数目为2NA |
 现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题: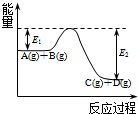 (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯.
(1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯.