题目内容
15.设NA为阿伏加德罗常数,下列叙述中正确的是( )| A. | 常温常压下,2.24L 氯气与氢氧化钠溶液完全反应转移的电子数为0.1NA | |
| B. | 标准状况下,1L辛烷完全燃烧后,所生成气体产物的分子数为8NA/22.4 | |
| C. | 0.1L 2mol•L-1的(NH4)2S溶液中含有的S2-数目为0.2 NA | |
| D. | 在含有4mol Si-O键的石英晶体中,氧原子的数目为2NA |
分析 A.常温常压下,Vm≠22.4L/mol;
B.标况下,辛烷为液态;
C.硫离子为弱酸根离子,水溶液中部分发生水解;
D.根据1mol硅原子形成4molSi-O键进行判断.
解答 解:A.常温常压下,Vm≠22.4L/mol,所以无法计算氯气的物质的量,故A错误;
B.标况下,辛烷为液态,不能使用气体摩尔体积,故B错误;
C.硫离子为弱酸根离子,水溶液中部分发生水解,所以0.1L 2mol•L-1的(NH4)2S溶液中含有的S2-数目小于0.2 NA,故C错误;
D.二氧化硅中,1mol硅原子形成4molSi-O键,所以含4mol Si-O键的石英晶体中,含有1mol二氧化硅,含有氧原子的数目为2NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积适用对象和使用条件,注意二氧化硅的结构,题目难度中等.

练习册系列答案
相关题目
3.下列物质中既属于芳香族化合物又属于醇的是( )
| A. |  | B. | 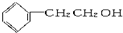 | C. | 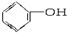 | D. | CH3CH2OH |
10.下列说法正确的是( )
| A. | 摩尔是表示物质粒子数量的单位 | B. | 物质的量可理解为物质的质量 | ||
| C. | 摩尔是表示物质的量的单位 | D. | 摩尔是七个基本物理量之一 |
7.某种分子的球棍模型如图所示(图中球与球之间的连线可代表单键、双键、叁键等):不同形式的球代表不同的原子,对该物质的判断正确的是( )
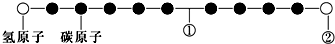

| A. | ①处的化学键是碳碳双键 | |
| B. | ②处的原子可能是氯原子 | |
| C. | 该分子中的原子不可能均在同一直线上 | |
| D. | 该分子不存在链状同分异构体 |
4.一定量的钠、铝合金置于水中,合金全部溶解,得到20ml、pH=14的溶液.然后用1mol/L的盐酸滴定至沉淀量最大时,消耗盐酸40ml.原合金中钠的质量为( )
| A. | 0.92g | B. | 0.69g | C. | 0.64g | D. | 0.23g |
5.下列叙述是小明做完铜、锌原电池的实验后得出的结论和认识,你认为正确的是( )
| A. | 构成原电池正极和负极的材料必须是两种活泼性不同的金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极 | |
| C. | 电子沿外导线由锌流向铜,内电路中电子通过稀硫酸被H+得到而放出氢气 | |
| D. | 铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过 |
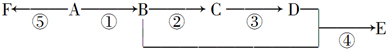
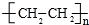 .
.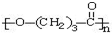 ),它可代替F,以减少“白色污染”. 聚丁内酯可用环丁内酯开环聚合而成,其工业生产方法和降解原理如下:
),它可代替F,以减少“白色污染”. 聚丁内酯可用环丁内酯开环聚合而成,其工业生产方法和降解原理如下: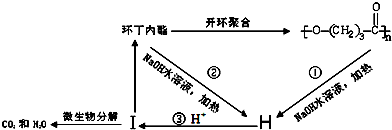
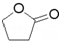 .
. .
.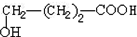 +9O2$\stackrel{微生物}{→}$8CO2↑+8H2O.
+9O2$\stackrel{微生物}{→}$8CO2↑+8H2O. ,E元素的周期表位置第三周期ⅥA族,乙的电子式为
,E元素的周期表位置第三周期ⅥA族,乙的电子式为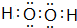 .
.