题目内容
14.化学与生产、生活密切相关.下列叙述正确的是( )| A. | 加热蒸干MgCl2饱和溶液,可制得氯化镁固体 | |
| B. | 明矾可用于水的消毒、杀菌 | |
| C. | 使用无磷洗衣粉,可缓解水体富营养化问题 | |
| D. | 用加热法可除去硬水中的CaCl2、MgCl2 |
分析 A.氯化镁溶液加热过程中镁离子易水解;
B.明矾没有强氧化性不能消毒、杀菌;
C.生活污水中N、P元素会造成水中藻类植物的大量生长,使水质变坏,造成水体富营养化;
D.CaCl2不水解,MgCl2能水解生成氢氧化镁.
解答 解:A.氯化镁溶液加热过程中镁离子易水解,而且生成的HCl易挥发,会使氯化镁完全水解,所以最终得不到氯化镁固体,故A错误;
B.明矾没有强氧化性不能消毒、杀菌,明矾在水中能形成氢氧化铝胶体,能吸附水中的悬浮杂质而净水,故B错误;
C.生活污水中N、P元素会造成成水体富营养化,所以使用无磷洗衣粉能减少磷元素的排放,从而缓解水体富营养化问题,故C正确;
D.CaCl2不水解,MgCl2能水解生成氢氧化镁,所以加热时MgCl2会水解转化为氢氧化镁沉淀,故加热法可以除去硬水中的MgCl2,但是不能除去CaCl2,故D错误.
故选C.
点评 本题考查了化学知识在生产生活中的应用,题目难度不大,化学来源于生产、生活,也服务于生产、生活,在实践中领会知识,平时应多注意理论联系实际.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
16.在溶液中能共存,加入OH-有沉淀析出,加入H+能放出气体的是( )
| A. | Mg2+、Na+、Cl-、CO32- | B. | Fe2+、NO3-、Na+、Cl- | ||
| C. | NH4+、K+、AlO2-、SiO32- | D. | Cu2+、NH4+、SO42+、Na+ |
2.烟道气中的CO2可用于合成甲醇和甲醚.
(1)如图所示为其中的一种方法:

①用光电池电解水时,阳极的电极反应式为4OH--4e-═O2↑+2H2O.
②15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,则HOCH2CH2NH3Cl的水溶液显酸(填“酸”“碱”或“中”)性.
③已知,CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.5kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l)的热化学方程式为CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9 kJ•mol-1.
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
①在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是bd(填序号).
a.生成1mol CH3OCH3(g)的同时,生成3mol H2O(l)
b.体系中混合气体的密度不随时间而变化
c.体系中CO2与H2的体积比为1:3
d.体系中的气体的总压强不随时间而变化
②已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
上述反应的化学平衡常数的表达式为$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$.该反应的焓变△H<0(填“>”、“<”或“=”,下同),若使a>45%,则x>1.5.
③在一定温度下,向体积为0.5L的密闭容器中加入2mol CO2和6mol H2,20min后达到平衡,测得平衡时CH3OCH3为0.5mol,则该反应的反应速率v(CO2)=0.1mol•L-1•min-1,H2的转化率α(H2)=50%;加入催化剂,v(CO2)增大(填“增大”、“减小”或“不变”,下同),α(H2)不变.
(1)如图所示为其中的一种方法:

①用光电池电解水时,阳极的电极反应式为4OH--4e-═O2↑+2H2O.
②15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,则HOCH2CH2NH3Cl的水溶液显酸(填“酸”“碱”或“中”)性.
③已知,CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.5kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l)的热化学方程式为CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9 kJ•mol-1.
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
①在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是bd(填序号).
a.生成1mol CH3OCH3(g)的同时,生成3mol H2O(l)
b.体系中混合气体的密度不随时间而变化
c.体系中CO2与H2的体积比为1:3
d.体系中的气体的总压强不随时间而变化
②已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比$\frac{n{H}_{2}p}{nC{O}_{2}p}$ | 500K | 600K | 700K |
| 1.5 | 45% | 33% | 20% |
| x | a | b | c |
③在一定温度下,向体积为0.5L的密闭容器中加入2mol CO2和6mol H2,20min后达到平衡,测得平衡时CH3OCH3为0.5mol,则该反应的反应速率v(CO2)=0.1mol•L-1•min-1,H2的转化率α(H2)=50%;加入催化剂,v(CO2)增大(填“增大”、“减小”或“不变”,下同),α(H2)不变.
19.下列说法正确的是( )
| A. | 标准状况下,将1.12L Cl2溶于水,转移电子数为0.05NA | |
| B. | 将含等物质的量的KHCO3和Ba(OH)2溶液混合,离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 常温下,由水电离出的H+浓度为10-13mol•L-1的溶液中,Fe2+、Cl-、Na+、NO3-一定能大量共存 | |
| D. | 葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+可以大量共存 |
3.下列物质中既属于芳香族化合物又属于醇的是( )
| A. | 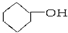 | B. | 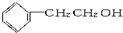 | C. | 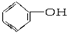 | D. | CH3CH2OH |
4.一定量的钠、铝合金置于水中,合金全部溶解,得到20ml、pH=14的溶液.然后用1mol/L的盐酸滴定至沉淀量最大时,消耗盐酸40ml.原合金中钠的质量为( )
| A. | 0.92g | B. | 0.69g | C. | 0.64g | D. | 0.23g |
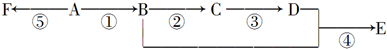
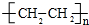 .
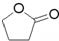
.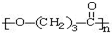 ),它可代替F,以减少“白色污染”. 聚丁内酯可用环丁内酯开环聚合而成,其工业生产方法和降解原理如下:
),它可代替F,以减少“白色污染”. 聚丁内酯可用环丁内酯开环聚合而成,其工业生产方法和降解原理如下: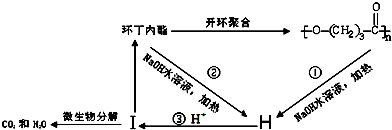
 .
. .
.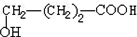 +9O2$\stackrel{微生物}{→}$8CO2↑+8H2O.
+9O2$\stackrel{微生物}{→}$8CO2↑+8H2O.