题目内容
7. 现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)④②③①.
(2)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是(填序号)⑥④⑤⑦.
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+).
(4)同体积、同物质的量浓度的①硫酸和②醋酸溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小关系为①>②(填“>”、“<”或“=”)
(5)同体积、相同PH的①硫酸和②醋酸溶液中分别投入足量且等质量的锌,开始放H2的速率:①=②,片刻后①<②,到反应结束,所用时间①>②
(6)已知t℃时,KW=1×10-13,则t℃(填“>”、“<”或“=”)>25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=9:2.
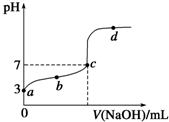
(7)已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是AE
A.a点表示溶液中c(CH3COO-)约为10-3 mol/L
B.b点表示的溶液中c(Na+)>c(CH3COO-)
C.c点表示CH3COOH和NaOH恰好反应完全
D.d点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})•(c({H}^{+})}{c(C{H}_{3}COOH)}$大于K
E.b、c、d三点表示的溶液中一定都存在:c(Na+)+c(H+)═c(CH3COO-)+c(OH-)
分析 (1)根据酸或碱均能抑制H2O的电离,且溶液中H+或OH-浓度越大、盐的水解能促进水的电离分析;
(2)氨水中电离出的铵根离子浓度最小,硫酸氢铵中的氢离子抑制了铵根离子的水解,碳酸氢铵中的碳酸氢根离子促进了铵根离子的水解,据此进行判断;
(3)根据二者完全反应生成等浓度的NaCl和NH3•H2O溶液分析;
(4)物质的量相等的硫酸和醋酸,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小与酸的元数成正比;
(5)pH相等的醋酸和硫酸溶液中,生成氢气的速率与氢离子浓度成正比,氢离子浓度相等则其反应速率相等;反应过程中,弱电解质电离导致弱电解质溶液中氢离子浓度大于强电解质溶液,所以弱电解质溶液反应速率大于强电解质溶液;
(6)水的电离是吸热反应,升高温度促进水电离,在水的离子积常数增大;根据混合溶液的pH计算两种溶液的体积之比;
(7)A.酸能抑制水的电离,再根据弱电解质的性质分析溶液中醋酸根离子的浓度.
B.任何溶液一定满足电荷守恒,根据电荷守恒进行判断;
C、根据醋酸和氢氧化钠生成盐的类型判断恰好反应时溶液的酸碱性,从而确定该选项是错误的;
D、电离平衡常数只与温度有关,与其它任何条件都无关;
E.根据溶液中的电荷守恒判断.
解答 解:(1)向溶液中加入酸或碱均能抑制H2O的电离,且溶液中H+或OH-浓度越大,由水电离出的H+浓度越小;盐的水解能促进水的电离,所以由水电离出c(H+)由大到小的顺序为:④②③①,
故答案为:④②③①;
(2)由于盐的水解程度较小,氨水为弱碱,则氨水中电离出的铵根离子浓度最小;硫酸氢铵中的氢离子抑制了铵根离子的水解,碳酸氢铵中的碳酸氢根离子促进了铵根离子的水解,则④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是:⑥④⑤⑦,
故答案为:⑥④⑤⑦;
(3)将③和④按体积比1:2混合后,二者完全反应生成等浓度的NaCl和NH3•H2O,由于NH3•H2O电离出氢氧根离子,所以溶液呈碱性,溶液中离子浓度大小关系为:c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+),
故答案为:c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+);
(4)物质的量相等的硫酸和醋酸,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小与酸的元数成正比,硫酸是二元酸、醋酸是一元酸,所以所需NaOH体积大小关系为①>②,
故答案为:>;
(5)pH相等的醋酸和硫酸溶液中,生成氢气的速率与氢离子浓度成正比,氢离子浓度相等则其反应速率相等,所以pH相等的醋酸和硫酸中开始反应速率相等;
随着反应的进行,硫酸中氢离子浓度减少,醋酸电离出氢离子导致醋酸中氢离子浓度大于硫酸,则反应速率为①<②;
硫酸的反应速率小于醋酸,所以反应时间①>②,
故答案为:=;<;>;
(6)水的电离是吸热反应,升高温度促进水电离,在水的离子积常数增大,t℃时,KW=1×10-13,则t℃>25℃,t℃时将pH=11的NaOH溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,
pH=1的H2SO4溶液中c(H+)=0.1mol/L,混合溶液中c(H+)=$\frac{0.1b-0.01a}{a+b}$mol/L=0.01mol/L,则a:b=9:2,
故答案为:>;9:2;
(7)A.a点是c(H+)=10-3mol/L,由于醋酸为弱酸,酸能抑制水的电离,醋酸的电离远远大于水的电离,所以溶液中氢离子浓度近似等于醋酸根离子浓度,即c(CH3COO-)约为10-3 mol/L,故A正确;
B.溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),b点时,溶液显示酸性,c(H+)>c(OH-),则有c(CH3COO-)>c(Na+),故B错误;
C、醋酸和氢氧化钠反应生成醋酸钠,醋酸钠是强碱弱酸盐其水溶液呈碱性,当酸碱恰好反应时溶液应该呈碱性,但C点溶液呈中性,说明酸过量,故C错误;
D、d点时溶液的温度没有变化,所以d点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=K,故D错误;
E.溶液中一定满足电荷守恒,根据电荷守恒可得:c(Na+)+c(H+)═c(CH3COO-)+c(OH-),故E正确;
故答案为:A E.
点评 本题考查较综合,涉及离子浓度大小的比较、弱电解质的电离、酸碱混合溶液定性判断等知识点,题目难度中等,根据弱电解质的电离特点、盐类水解特点结合溶液酸碱性来确定离子浓度大小.

| A. | 12C和14C互为同位素 | |
| B. | 乙醇与二甲醚(CH3-O-CH3)互为同分异构体 | |
| C. | H2O与D2O互为同位素 | |
| D. | 红磷与白磷互为同素异形体 |
| A. | 原电池中电子流出的极为负极,发生氧化反应 | |
| B. | 原电池中阴离子向正极移动 | |
| C. | 原电池是将电能转化为化学能的装置 | |
| D. | 原电池正极上发生氧化反应 |
| A. | Li、Be、B原子最外层电子数逐渐增多 | |
| B. | P、S、Cl最高正价依次升高 | |
| C. | N、O、F得电子能力逐渐减弱 | |
| D. | Li、Na、K、Rb的金属性依次增强 |
| A. | Mg2+、Na+、Cl-、CO32- | B. | Fe2+、NO3-、Na+、Cl- | ||
| C. | NH4+、K+、AlO2-、SiO32- | D. | Cu2+、NH4+、SO42+、Na+ |
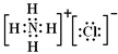 .⑦的电子式为
.⑦的电子式为 .
.
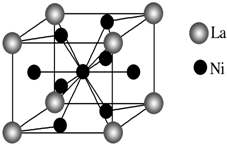 金属镍及其化合物在合金材料以及催化剂等方面应用广泛,请回答下列问题.
金属镍及其化合物在合金材料以及催化剂等方面应用广泛,请回答下列问题.