题目内容
2.下列化合物中,既有酸性又能发生酯化反应和消去反应的是( )| A. | 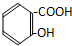 | B. | 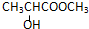 | ||
| C. | CH2=CH-COOH | D. | 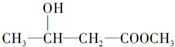 |
分析 酚-OH、-COOH具有酸性,-OH、-COOH可发生酯化反应,-OH可发生消去反应,但与-OH相连的C的邻位C上必须有H,以此来解答.
解答 解:A.含酚-OH、-COOH,具有酸性、可发生酯化反应,但不能发生消去反应,故A不选;
B.含-COOH具有酸性,含-OH、-COOH可发生酯化反应,且与-OH相连的C的邻位C上有H,可发生消去反应,故B选;
C.含-COOH,具有酸性、可发生酯化反应,但不能发生消去反应,故C不选;
D.含-OH可发生酯化反应,且与-OH相连的C的邻位C上有H,可发生消去反应,但不具有酸性,故D不选;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、醇、羧酸性质的考查,题目难度不大,注意醇消去反应的结构特点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列说法中正确的是( )
| A. | 原电池中电子流出的极为负极,发生氧化反应 | |
| B. | 原电池中阴离子向正极移动 | |
| C. | 原电池是将电能转化为化学能的装置 | |
| D. | 原电池正极上发生氧化反应 |
13.下列有关比较中,大小顺序排列错误的是( )
| A. | 物质的熔点:石英>食盐>冰>汞 | |
| B. | 热稳定性:PH3>H2S>HBr>NH3 | |
| C. | 微粒半径由大到小顺序是:H->Li+>H+ | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
2.烟道气中的CO2可用于合成甲醇和甲醚.
(1)如图所示为其中的一种方法:

①用光电池电解水时,阳极的电极反应式为4OH--4e-═O2↑+2H2O.
②15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,则HOCH2CH2NH3Cl的水溶液显酸(填“酸”“碱”或“中”)性.
③已知,CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.5kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l)的热化学方程式为CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9 kJ•mol-1.
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
①在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是bd(填序号).
a.生成1mol CH3OCH3(g)的同时,生成3mol H2O(l)
b.体系中混合气体的密度不随时间而变化
c.体系中CO2与H2的体积比为1:3
d.体系中的气体的总压强不随时间而变化
②已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
上述反应的化学平衡常数的表达式为$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$.该反应的焓变△H<0(填“>”、“<”或“=”,下同),若使a>45%,则x>1.5.
③在一定温度下,向体积为0.5L的密闭容器中加入2mol CO2和6mol H2,20min后达到平衡,测得平衡时CH3OCH3为0.5mol,则该反应的反应速率v(CO2)=0.1mol•L-1•min-1,H2的转化率α(H2)=50%;加入催化剂,v(CO2)增大(填“增大”、“减小”或“不变”,下同),α(H2)不变.
(1)如图所示为其中的一种方法:

①用光电池电解水时,阳极的电极反应式为4OH--4e-═O2↑+2H2O.
②15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,则HOCH2CH2NH3Cl的水溶液显酸(填“酸”“碱”或“中”)性.
③已知,CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.5kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l)的热化学方程式为CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9 kJ•mol-1.
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
①在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是bd(填序号).
a.生成1mol CH3OCH3(g)的同时,生成3mol H2O(l)
b.体系中混合气体的密度不随时间而变化
c.体系中CO2与H2的体积比为1:3
d.体系中的气体的总压强不随时间而变化
②已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比$\frac{n{H}_{2}p}{nC{O}_{2}p}$ | 500K | 600K | 700K |
| 1.5 | 45% | 33% | 20% |
| x | a | b | c |
③在一定温度下,向体积为0.5L的密闭容器中加入2mol CO2和6mol H2,20min后达到平衡,测得平衡时CH3OCH3为0.5mol,则该反应的反应速率v(CO2)=0.1mol•L-1•min-1,H2的转化率α(H2)=50%;加入催化剂,v(CO2)增大(填“增大”、“减小”或“不变”,下同),α(H2)不变.
19.下列说法正确的是( )
| A. | 标准状况下,将1.12L Cl2溶于水,转移电子数为0.05NA | |
| B. | 将含等物质的量的KHCO3和Ba(OH)2溶液混合,离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 常温下,由水电离出的H+浓度为10-13mol•L-1的溶液中,Fe2+、Cl-、Na+、NO3-一定能大量共存 | |
| D. | 葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+可以大量共存 |
 .
.
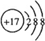 ,E元素的周期表位置第三周期ⅥA族,乙的电子式为
,E元素的周期表位置第三周期ⅥA族,乙的电子式为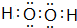 .
.