题目内容
8. (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯.
(1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯.已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ•mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ•mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2 (g)+H2(g)的△H=+124.2kJ•mol-1.
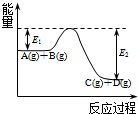
(2)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
①该反应是放热反应(填“吸热”“放热”);
②在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1减小,E2减小(填“增大”“减小”“不变”);
③反应体系中加入催化剂对反应热是否有影响?不影响,原因是催化剂不改变平衡的移动.
分析 (1)根据盖斯定律,由已知热化学方程式乘以合适的系数进行加减构造目标目标热化学方程式,反应热也乘以相应的系数,进行相应的加减,据此计算;
(2)①分析图象中物质能量变化可知AB反应物能量高于生成物CD,反应是放热反应;
②加催化剂能降低反应的活化能;
③催化剂改变反应速率,不改变化学平衡,反应热不变.
解答 解:(1)已知:①C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ•mol-1
②CH3CH=CH2(g)═CH4(g)+HC≡CH(g )△H2=+32.4kJ•mol-1
根据盖斯定律,①-②得C3H8(g)═CH3CH=CH2(g)+H2(g),所以△H=△H1-△H2=156.6kJ•mol-1-32.4kJ•mol-1=+124.2kJ•mol-1;
故答案为:+124.2;
(2)①分析图象中物质能量变化可知AB反应物能量高于生成物CD,反应是放热反应,A(g)+B(g)?C(g)+D(g)过程中的能量变化为放热,
故答案为:放热;
②其它条件不变在反应体系中加入催化剂,能同等程度地改变正逆反应速率,降低了反应的活化能,反应物和生成物的活化能都会降低,E1减小、E2减小,
故答案为:减小;减小;
③其它条件不变在反应体系中加入催化剂,改变反应速率,不改变化学平衡,反应热不变所以对反应热无影响,
故答案为:不影响;催化剂不改变平衡的移动.
点评 本题考查了化学反应能量变化的分析判断和盖斯定律的应用以及影响化学平衡的因素分析,注意催化剂改变反应速率不改变化学平衡,题目较简单.

练习册系列答案
相关题目
19.下列各组元素性质递变情况错误的是( )
| A. | Li、Be、B原子最外层电子数逐渐增多 | |
| B. | P、S、Cl最高正价依次升高 | |
| C. | N、O、F得电子能力逐渐减弱 | |
| D. | Li、Na、K、Rb的金属性依次增强 |
16.在溶液中能共存,加入OH-有沉淀析出,加入H+能放出气体的是( )
| A. | Mg2+、Na+、Cl-、CO32- | B. | Fe2+、NO3-、Na+、Cl- | ||
| C. | NH4+、K+、AlO2-、SiO32- | D. | Cu2+、NH4+、SO42+、Na+ |
3. 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.
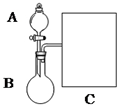
(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少量氨 气.已知:NH3•H2O+CaO═Ca(OH)2+NH3↑.
①生石灰应该装在B(填A或B).
②试从电离平衡角度分析该实验中氨气逸出的原因:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置.
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显.影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:水浴加热的条件.
②你设计实验验证上述“因素一”,完成下表中内容.
提供试剂:乙醛、2%稀氨水、0.25mol/L NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少量氨 气.已知:NH3•H2O+CaO═Ca(OH)2+NH3↑.
①生石灰应该装在B(填A或B).
②试从电离平衡角度分析该实验中氨气逸出的原因:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置.
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显.影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:水浴加热的条件.
②你设计实验验证上述“因素一”,完成下表中内容.
提供试剂:乙醛、2%稀氨水、0.25mol/L NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
| 实验步骤 | 实验操作 | 预期现象及结论 (步骤1只写现象) |
| 1 | 在A、B两支洁净的试管中各加入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至沉淀恰好溶解,此时制得pH均约为8的银氨溶液. | 先生成白色沉淀 后沉淀溶解 |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加1滴NaOH溶液;振荡后将两支试管放在热水浴中温热. | 若A试管比B试管出现的银镜时间短、光亮,则则溶液pH大 反应速率快; 若A试管比B试管出现的银镜时间长,则则溶液pH大 反应速率慢. |
13.下列有关比较中,大小顺序排列错误的是( )
| A. | 物质的熔点:石英>食盐>冰>汞 | |
| B. | 热稳定性:PH3>H2S>HBr>NH3 | |
| C. | 微粒半径由大到小顺序是:H->Li+>H+ | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
20.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 1mol CH3+(碳正离子)中含有电子数为10NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1mol乙烷分子含有8NA个共价键 |
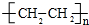 .
.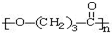 ),它可代替F,以减少“白色污染”. 聚丁内酯可用环丁内酯开环聚合而成,其工业生产方法和降解原理如下:
),它可代替F,以减少“白色污染”. 聚丁内酯可用环丁内酯开环聚合而成,其工业生产方法和降解原理如下: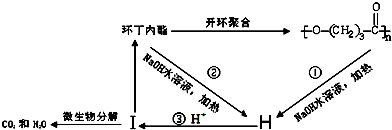
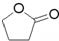 .
. .
.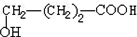 +9O2$\stackrel{微生物}{→}$8CO2↑+8H2O.
+9O2$\stackrel{微生物}{→}$8CO2↑+8H2O.