题目内容
10.下列对一些实验事实和理论解释正确的是( )| 选项 | 实验事实 | 理论解释 |
| A | HCl气体溶于水,能导电 | HCl为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | HF分子间形成有氢键 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.HCl中只含共价键,为共价化合物;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,与其氢化物的水溶液酸性强弱无关;
C.含有自由移动的离子或电子的物质能导电;
D.含有分子间氢键的物质导致其熔沸点升高.
解答 解:A.HCl中只含共价键,为共价化合物,但HCl在水分子的作用下能电离出自由移动的离子,解释错误,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,与其氢化物的水溶液酸性强弱无关,所以不能根据HCl、HBr水溶液酸性强弱判断非金属性,故B错误;
C.含有自由移动的离子或电子的物质能导电,K3C60在熔融状态下能够导电且是化合物,说明该物质中含有离子键,故C正确;
D.含有分子间氢键的物质导致其熔沸点升高,HF中含有氢键、HCl中不含氢键,所以氢键导致HF的沸点高于HCl,故D正确;
故选CD.
点评 本题考查非金属性强弱判断、氢键、离子键等知识点,侧重考查基本理论,知道金属、非金属性强弱判断方法,知道氢键对物质物理性质的影响,题目难度不大.

练习册系列答案
相关题目
20.NA代表阿伏伽德罗常数的数值,下列说法中正确的是( )
| A. | 1mol铁完全反应,一定失去2NA个电子 | |
| B. | 1mol任何物质都约含6.02×1023个分子 | |
| C. | 等物质的量的NO和NO2含的N原子数均为1mol | |
| D. | 标况下,22.4L氦气所含的原子总数为NA |
1. “低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
“低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol;则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2,构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
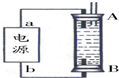
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如表:
①该反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,△H<0(填“>”、“<”或“=”).
②在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006mol•L-1,CO的平衡转化率为60%.
③欲提高②中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
 “低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
“低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol;则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2,构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如表:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
②在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006mol•L-1,CO的平衡转化率为60%.
③欲提高②中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
18.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
| A. | CCl4和PCl3 | B. | NaCl和HCl | C. | CO2和SiO2 | D. | NaH和Na2O2 |
15.下列说法不正确的是( )
| A. | H2S、H2O、HF的热稳定性依次增强 | |
| B. | NaOH、KOH、Mg(OH)2的碱性依次减弱 | |
| C. | 在过渡元素中寻找优良的催化剂 | |
| D. | 在周期表中金属元素与非金属元素交界处寻找半导体材料 |
2.下列叙述中不正确的是( )
| A. | 油脂属于酯类 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物 | |
| C. | 煤的干馏产物中含有芳香烃 | |
| D. | 质量相等的乙烯和丙烯完全燃烧消耗的氧气的物质的量相同 |
 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了能量最低、泡利原理和洪特规则.
,这样排布遵循了能量最低、泡利原理和洪特规则.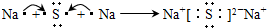 .
.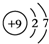 ,五种元素原子半径从大到小的顺序是Na、Si、O、F、H(填元素符号);
,五种元素原子半径从大到小的顺序是Na、Si、O、F、H(填元素符号); ,ED4的电子式是
,ED4的电子式是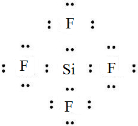 ;
; Na2O2
Na2O2
 →
→ 、MgCl2
、MgCl2 .
.